Немецкие и американские исследователи пришли к выводу, что расстройства сна при хронических заболеваниях сердца связаны с нарушением симпатической иннервации шишковидного тела, вырабатывающей мелатонин, связанными с сердцем провоспалительными иммунными клетками.
У людей и других млекопитающих смену периодов сна и бодрствования контролирует секреция мелатонина, синхронизированная с 24-часовым циклом смены дня и ночи на Земле. Этот гормон вырабатывает шишковидное тело (эпифиз), расположенное в надталамической области головного мозга, в ответ на уровень симпатической иннервации из верхнего шейного узла. Помимо эпифиза и некоторых других органов этот узел иннервирует и сердце. Известно, что при хронических сердечных заболеваниях зачастую снижается уровень мелатонина и возникают сопутствующие нарушения сна, которые негативно сказываются на течении болезни и качестве жизни пациента. Механизмы этого явления изучены не были, при этом они могли бы дать почву для разработки новых методов лечения.
Чтобы разобраться в этом вопросе, сотрудники различных научных центров Германии и США под руководством Штефана Энгельхардта (Stefan Engelhardt) из Мюнхенского технологического института изучили посмертные препараты эпифизов семи человек с кардиологическими заболеваниями и девяти без них. Оказалось, что при болезнях сердца значительно снижена плотность аксонов (то есть иннервация) в этой железе.
Выяснив это, авторы работы перешли к экспериментам на мышах с двумя искусственно вызванными заболеваниями сердца: перегрузкой левого желудочка давлением путем хирургического сужения аорты и сердечной недостаточностью с сохранной фракцией выброса. Уровень мелатонина у таких животных был снижен, что сопровождалось нарушениями циркадианных ритмов. Генетическая маркировка помогла выявить у них резкое снижение симпатической иннервации эпифиза без нарушения его внутренней структуры и анатомического окружения.
Морфометрическое и гистологическое исследование верхнего шейного узла продемонстрировало его значительную гипертрофию с замещением фиброзной соединительной тканью, что свидетельствует о тяжелом, возможно необратимом повреждении органа. Аналогичные изменения исследователи увидели на посмертных препаратах верхних шейных узлов кардиологических пациентов — рубцовая ткань замещала до 70 процентов их объема. При этом степень поражения узла значительно коррелировала со степенью ремоделирования миокарда в результате заболевания. Это подтвердили у живых пациентов с помощью УЗИ, а также обнаружили у них связь размеров верхнего шейного узла с фракцией выброса (функциональным показателем сердечной деятельности).
После этого авторы работы выполнили секвенирование РНК одиночных клеток и ядер верхнего шейного узла мышей с кардиологическими заболеваниями, а также иммуногистохимическое окрашивание разных пулов его клеток и нервных связей с эпифизом. Выяснилось, что симпатическая иннервация железы значительно снижалась еще до декомпенсации сердечной недостаточности, и что при этом узел инфильтрирован провоспалительными макрофагами. В нервных узлах, не иннервирующих сердце, подобной инфильтрации не наблюдалось, уровни биомаркеров общего воспаления повышены не были, что свидетельствует о связи этих макрофагов именно с заболеванием сердца. Схожую картину удалось пронаблюдать и в посмертных образцах кардиологических пациентов.
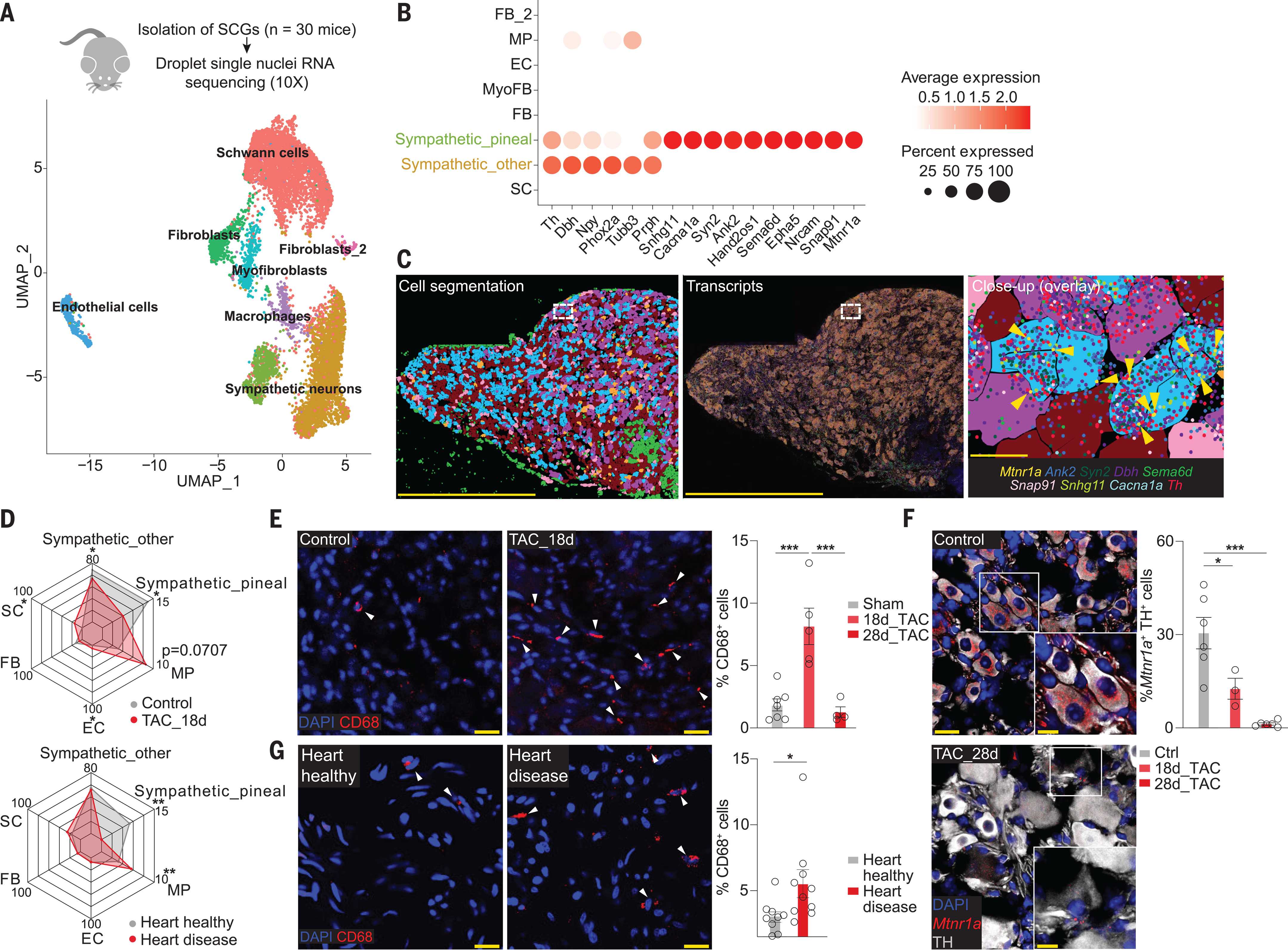
Транскриптомное профилирование межклеточных взаимодействий в верхнем шейном узле мышей на ранних стадиях болезни сердца показало, что сильнее всего нарушены связи между макрофагами и симпатическими нейронами, иннервирующими шишковидное тело. Еженедельные инъекции ингибитора макрофагов клодроната в этот узел сразу после операции по сужению аорты предотвращали денервацию железы и снижение уровня мелатонина. Эксперименты по совместному выращиванию клеток на питательной среде, подтвердили, что центральную роль в гибели симпатических нейронов играют активированные провоспалительные макрофаги.
Публикация об этом появилась в журнале Science.
Автор: Олег Лищук