У расхожего мифа о том, что нервные клетки не восстанавливаются, есть вполне научные истоки. Нейроны могут регенерировать, но делают это плохо и медленно, особенно если речь идет о центральной нервной системе.
Однако ученым удалось найти способ исправить этот недостаток. В лабораторных условиях глазному нерву крысы при помощи белка протрудина вернули способность к самовосстановлению.
Тела высших млекопитающих демонстрируют потрясающие способности к компенсации травм. Многие органы способны брать на себя часть функции поврежденных, а ткани — регенерировать. Но есть одна система организма, нарушение работы которой приносит, пожалуй, больше всего неудобств. Лишившиеся руки, ноги или почки люди через некоторое время и вовсе забывают о том, что они у них были. Полной жизнью, с некоторыми ограничениями, конечно, получается жить и без них.
А вот потеря возможности управлять конечностями при их внешней сохранности существенно снижает качество жизни. Часть тела, вроде, есть, а толку от нее почти нет. Что уж говорить про центральную нервную систему и мозг — фактически, эти сложнейшие структуры полностью определяют нашу личность. Малейшие травмы ЦНС катастрофически сказываются на качестве жизни. И как назло, составляющие ее нейроны очень с большим трудом способны защищаться от повреждений или восстанавливаться после них.
При этом их «коллеги» из периферической нервной системы подвержены этому недостатку в меньшей степени. Нарушения в целостности нейронов конечностей или внутренних органов относительно быстро заживают. В некоторых случаях удается полностью восстановить поврежденные нервные пути или буквально простимулировать рост новых. Что удивительнее всего, незрелые нейроны (в том числе в ЦНС), в начале своего развития тоже обладают хорошо развитой способностью к регенерации. Просто они теряют ее с возрастом.
Ученые из Кембриджского университета вместе с коллегами из США и Швеции нашли один из механизмов, приводящих к этим изменениям. Научная работа с описанием их умозаключений и экспериментов была опубликована в рецензируемом журнале Nature Communications.
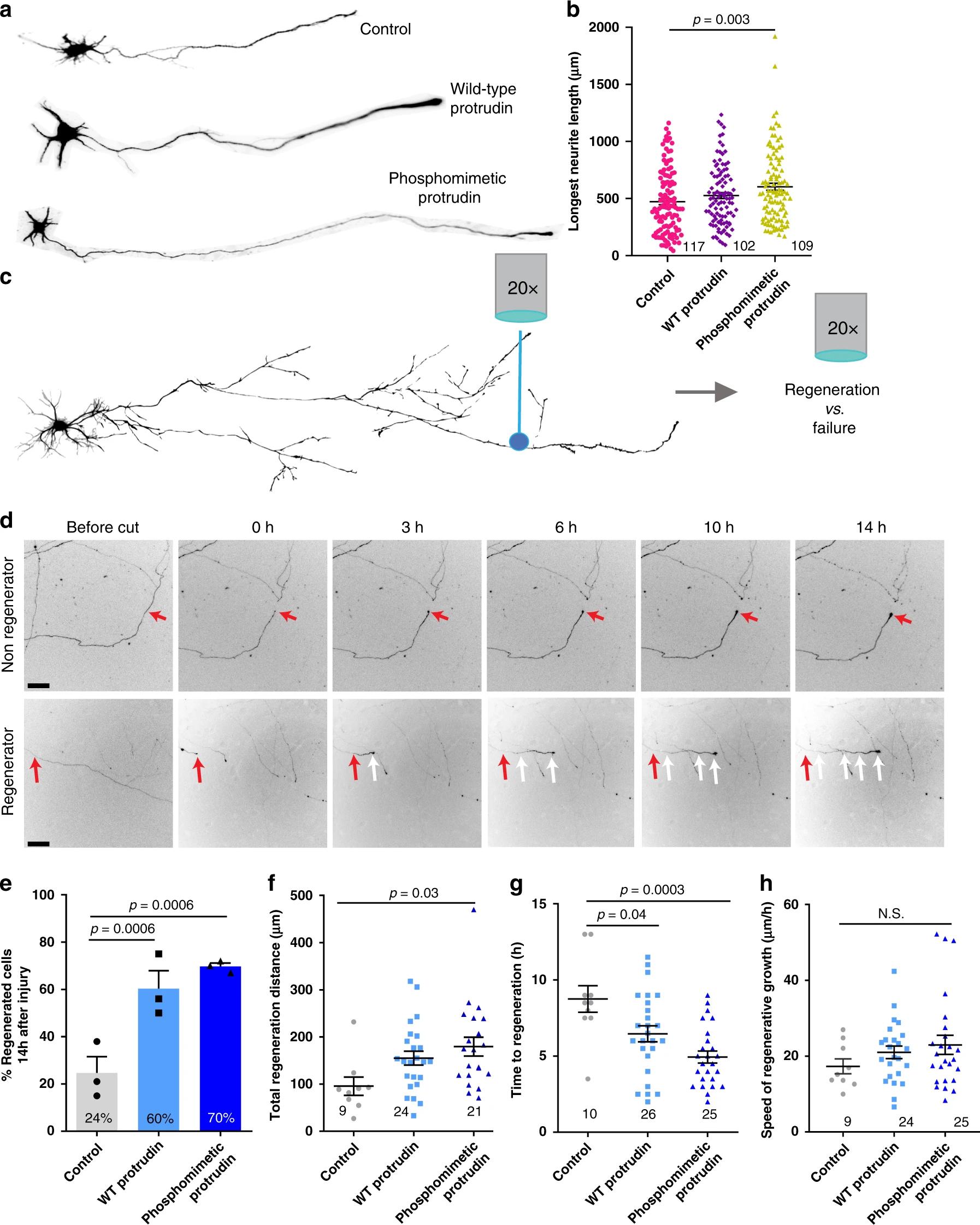
Между зрелыми и незрелыми нейронами, а также клетками ЦНС и периферической нервной системы было найдено важное отличие. В развивающихся нейронах больше всего белка протрудина, в клетках периферической нервной системы его значительно меньше, а в ЦНС он и вовсе почти не вырабатывается. При этом, как смогли установить биологи, это соединение играет наиважнейшую роль в способности нервных клеток сопротивляться физическим повреждениям.
Разработав механизм повышения экспрессии протрудина в нейронах, ученые проверили, можно ли его применить к живым клеткам. Для этого в чашке петри на питательной подложке высадили нейроны глазного нерва крысы. В них активировали выработку «защитного» белка и затем лазером перерубили аксоны. Всего за 14 часов поврежденная нервная клетка, в которой была значительно увеличена выработка протрудина, смогла заметно восстановить свой отросток. Тогда как контрольный, «обычный» нейрон, рост и восстановление демонстрировал с гораздо меньшей скоростью.
Эксперименты провели и на живых крысах. Качество восстановления глазного нерва оценить уже было не так просто, а вот устойчивость клеток к внешним воздействиям — легко. Спустя две недели после введения РНК, которая стимулирует выработку протрудина, под сетчатку мышей с поврежденным глазным нервом, их усыпили. И вырезали изучаемые органы — глазной нерв и саму сетчатку. Оказалось, что по сравнению с контрольной группой, у этих животных количество здоровых клеток было больше. Восстановились ли функции нерва — не проверялось.
Отдельно стоит отметить, что протрудин показал эффективность и в сохранении жизнеспособности нервных клеток. Те нейроны, в которых его выработка была простимулирована, вне тела жили на день больше, чем обычно.
В норме этот белок является важной частью эндоплазматического ретикулума. Данный органоид выполняет массу функций внутри клетки: способствует синтезу белков, переносит их и продукты синтеза по клетке, а также накапливает множество жизненно необходимых биологически активных молекул. Почему у зрелых нейронов закрепилась мутация, ограничивающая выработку протрудина — до конца неясно.
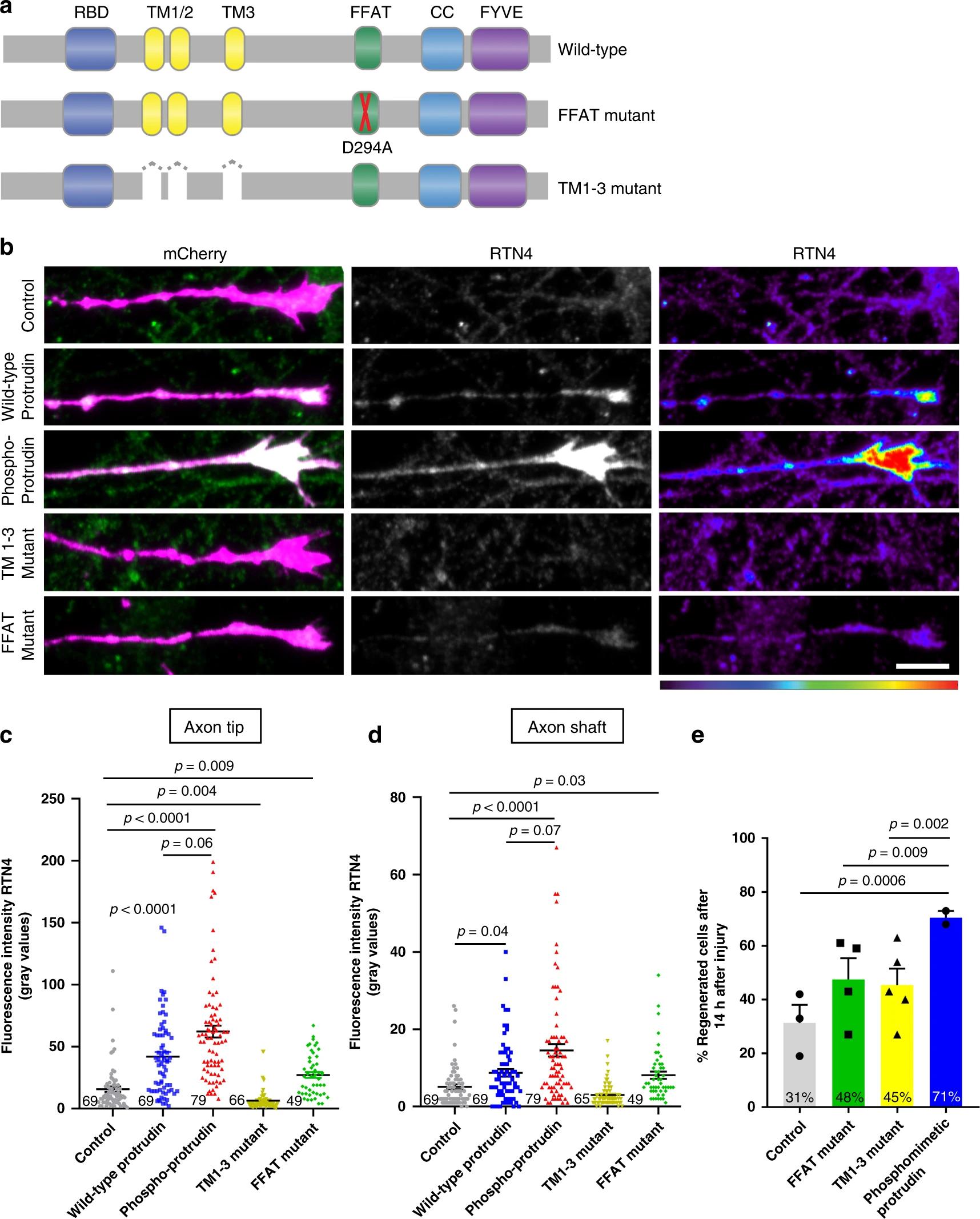
Однако сделанное учеными Кембриджского университета открытие может привести к совершенно новому направлению в медицине. Пока что генная терапия имеет очень ограниченное применение на человеке, но это временно. В перспективе для восстановления поврежденных нервов не нужно будет прибегать к сложнейшим микрохирургическим операциям и длительной терапии. Будет достаточно одного-двух уколов непосредственно в области травмы.
Свою следующую научную работу авторы вышеописанной публикации собираются посвятить восстановлению спинного мозга. Возможно, открытый ими механизм покажет свою эффективность не только для глазного нерва, а для всей нервной системы. Тогда протрудин имеет все шансы стать основой лекарств-нейропротекторов широкого спектра действия.
Автор: Василий Парфенов
