Многие истории про получение Нобелевской премии по физиологии или медицине в пересказе СМИ выглядят приблизительно так: был гений (или группа гениев), которым пришла в голову гениальнейшая идея, которая никому до этого в голову не приходила, и никто никогда даже не задумывался над этим.
На следующее утро гений, молча (что тут обсуждать?), быстренько сделал эксперименты, завтра опубликовал их и отправился ждать свою Нобелевскую премию, которую получил в итоге через N лет (где N обычно – цифра гораздо больше 10).
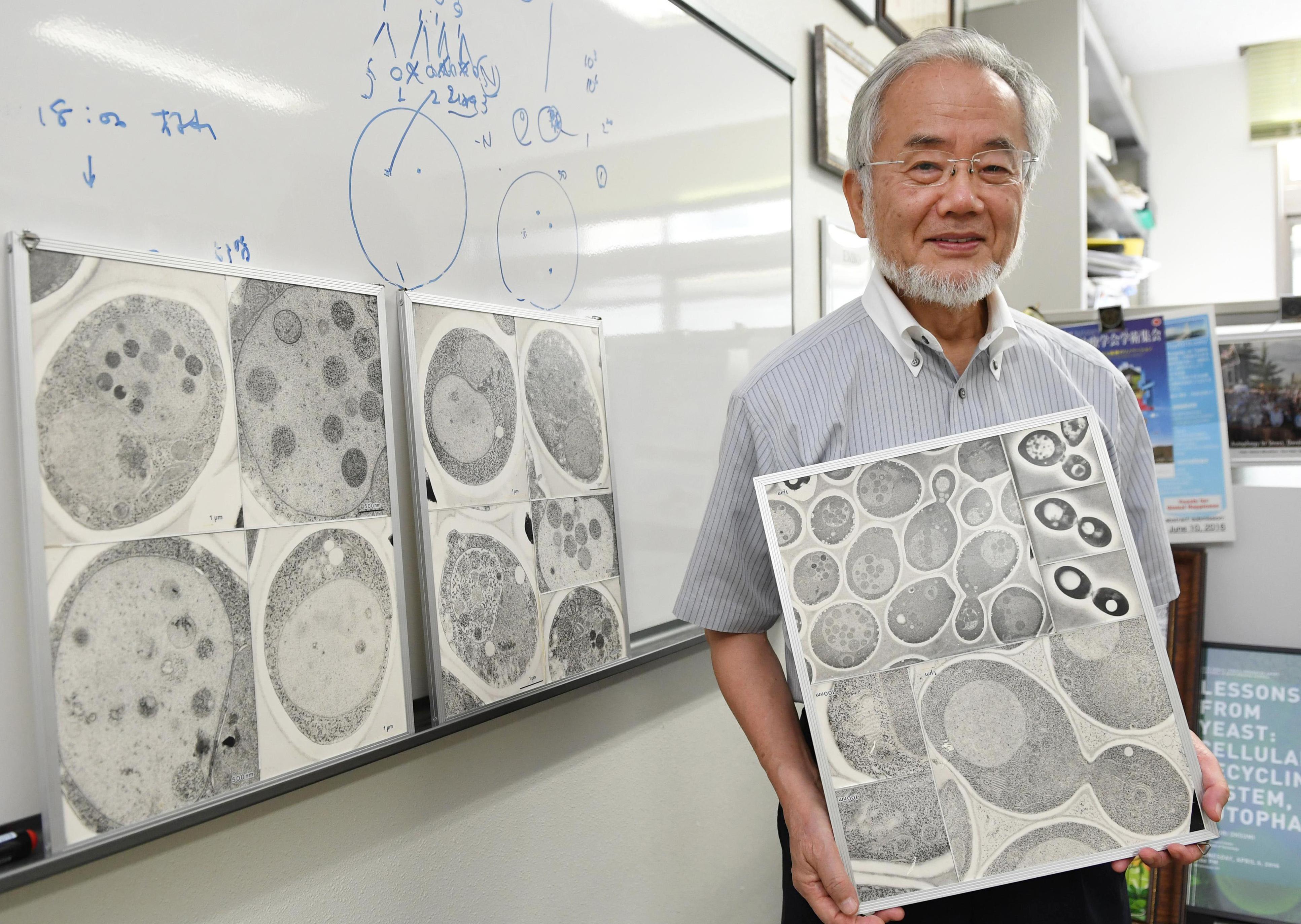
На самом деле открытия в науке происходят не так. Любая идея не кристаллизируется из вакуума в идеально чистую форму за одну ночь, а, напротив, представляет собой результат синтеза исследований многих людей, работавших над этой проблемой до Нобелевского лауреата, в комбинации с долгими и упорными экспериментами самого лаурета. Нобелевская премия по физиологии или медицине, врученная за открытие аутофагии Ёсинори Осуми в 2016 году — хорошая иллюстрация этого сценария.
Первые «самоеды» на деревне
Принцип «всё течет, всё изменяется» предложил ещё Гераклит. Тем не менее, даже пятьдесят лет назад идея того, что клетка очень динамична, и в ней постоянно происходят процессы как созидания, так и разрушения, казалась крайне революционной. Многие биологи считали, что белки после того, как образовывались внутри клетки, оставались неизменными, ведь «внешний вид» клеток тоже особо не менялся (сейчас известно, что белки, из которых состоит наш организм, обновляются в среднем каждые 1-2 месяца).
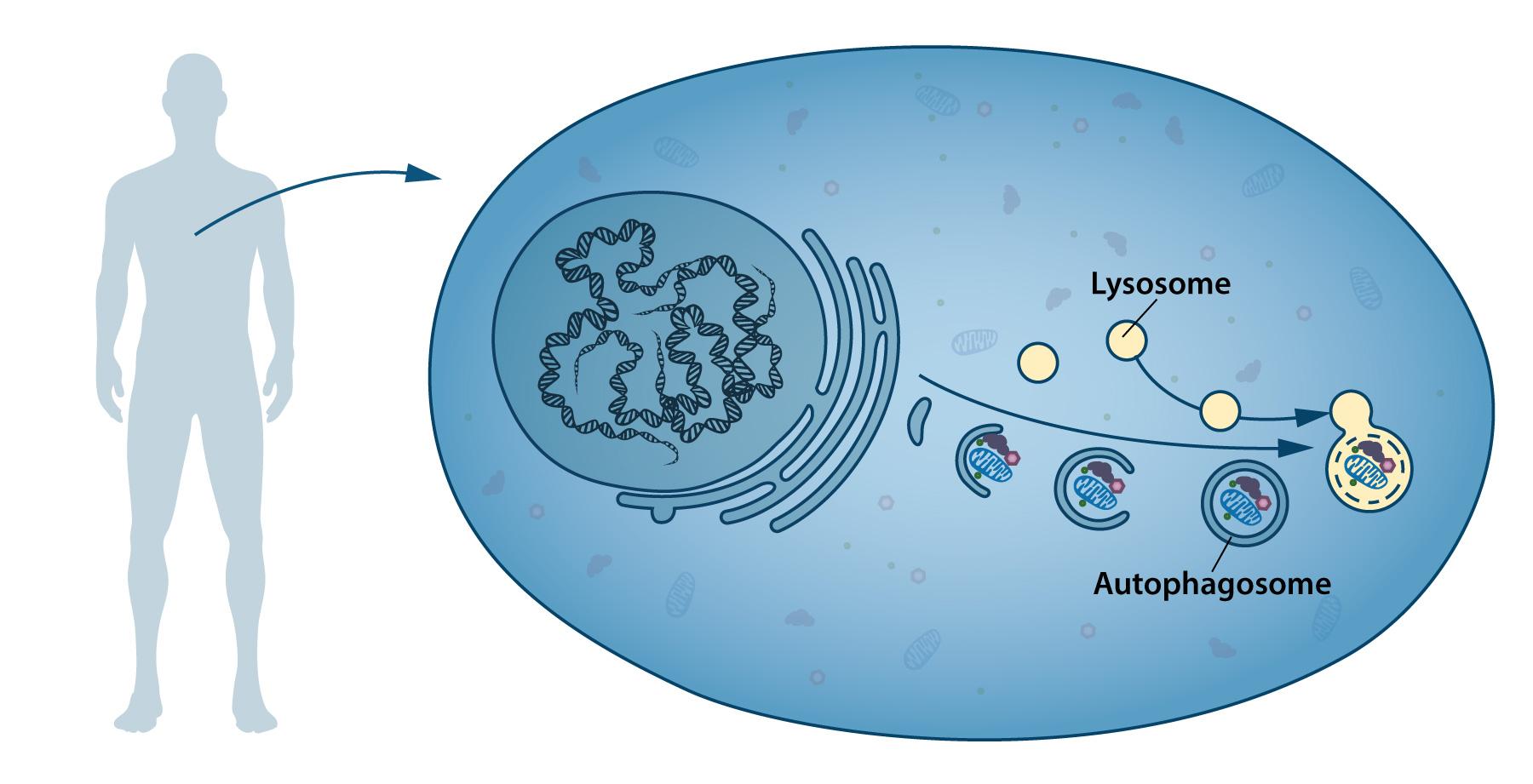
Начало изучению того, как белки деградируют внутри клетки, положил Кристиан де Дюве, бельгийский биохимик, который получил свою Нобелевскую премию по медицине ещё в 1974, в том числе и за открытие лизосом. Лизосомы – это ключевые органеллы для преобразования ненужных клеточных элементов в отдельные «кирпичики», которые клеточная «фабрика» сможет затем повторно использовать. Он же и предложил термин «аутофагия» («самопоедание») для того, чтобы описать процеcc доставки клеткой кусочков своей же собственной цитоплазмы к лизосомам. Сделал он это в 1963 году, когда нынешний лауреат Нобелевской премии, Ёсинори Осуми, только-только поступил на первый курс Университета Токио.
Кристиан де Девю и его коллеги (в том числе Алекс Новиков, американский биолог с украинскими корнями) заметили, что клетка может захватывать часть своей цитоплазмы и окружать её мембраной, тем самым образуя аутофагосому, которая затем сливается с лизосомами для расщепления содержимого. Первые доклады на тему аутофагии начали появляться в 1967 году.
Таким образом, когда в конце 1980-х годов Ёсинори Осуми начинает работать над проблемой аутофагии, у него уже есть некоторый старт: название процесса, который он изучает, и тот факт, что этот процесс можно увидеть в срезах под электронном микроскопом (правда, это трудно и долго). Ключевая проблема состояла в том, что аутофагосомы в клетке крайне непостоянны — через 10 минут после их образования они уже сливались с лизосомами. Это тормозило изучение их функции.
Из невидимого в видимое
Поколение биохимиков, которое исследовало аутофагию до нобелевского лауреата 2016 года, работало в основном с клетками животных — они были большие по размеру, а следовательно, наблюдение за ними под микроскопом особого труда не составляло.
Ёсинори Осуми, наоборот, фокусируется на модельном организме — одноклеточных дрожжах, меньших по размеру, чем клетки животных, но и более лёгких в обращении. Они содержали меньше генов, а, значит, из них легче получались «мутанты». Он находит способ затормозить процесс аутофагии — сначала ограничить дрожжи в питательных веществах (в условиях голода клетки дрожжей начинали активно «откусывать» от себя по кусочку, чтобы хоть как-то продержаться), а затем мутировать ген вакуолярной протеазы, в результате чего аутофагосомы не исчезали из клеток дрожжей так быстро и становились хорошо видными под обыкновенным световым, а не электронным микроскопом.
Имея это преимущество, в начале 1990-х он опубликовал ключевые работы по аутофагии: разобрался с тем, когда и сколько образуется мембран у аутофагосом, а также создал мутантные дрожжевые клетки, у которых обнаруживались дефекты на разных стадиях аутофагии. Тем самым он начал раскручивать механизм и функцию этого процесса.
В научном обзоре 2014 года, написанном для журнала Cell Research, Ёсинори Осуми выделяет следующие вехи в исследованиях аутофагии применительно к отдельным органам или процессам, а также словно между делом демонстрирует, что у него получилось создать в Японии очень сильное направление в исследованиях по аутофагии – большинство ключевых исследований японские:
- 2004 год: аутофагия необходима для борьбы с внутриклеточными инфекциями (группа Тамотсу Есимори, Университет Осаки);
- 2006 год: создана трансгенная мышь, у которой был заторможен процесс аутофагии в нейронах; у такой мыши нейроны деградировали (группа Нобору Мизусима, Университет Токио);
- 2007 год: в отсутствии аутофагии печень увеличивалась, и развивались опухоли; соответственно, аутофагия вносит вклад в развитие рака (группа Кейжи Танака, Университет Токио);
- 2008 год: сразу после оплодотворения в клетке запускается процесс аутофагии, она также необходима для раннего развития (группа Нобору Мизусима, Университет Токио).
Аутофагия и нейроны
Как мы видим, историю исследований аутофагии в нейробиологии можно отсчитывать только с 2006 года, когда учёные продемонстрировали критическое значение аутофагии для нейронов. Тем не менее, ключевые аргументы, почему аутофагия особенно важна для нейронов, были известны задолго до 2006 года. И в данный момент исследования связи аутофагия-нейроны вращаются именно вокруг них.
А аргументы эти выглядят следующим образом:
- Взрослые нейроны не могут делиться, но в то же время они сохраняются на всю жизнь – соответственно, внутриклеточный баланс «строим/разрушаем» для них особенно актуален.
- Строение клеток нейронов ассиметричное, и его необходимо поддерживать: не просто разрушать, а разрушать в весьма определённом месте – в аксоне, дендрите или теле нейрона.
- Нейроны особенно чувствительны к скоплениям агрегатов РНК или белков. Например, амилоидные бляшки в нейронах, видимые при окрашивании клетки, представляют собой прямой признак болезни Альцгеймера. Аутофагия — тот самый процесс, который может помочь очистить клетку от этих самых агрегатов, если они вдруг образовались.
- Аутофагия также ответственна за то, чтобы очищать клетку от повреждённых митохондрий — органелл, представляющих собой настоящие внутриклеточные теплоэлектростанции. При повреждении клетки (например, от недостатка кислорода — ишемия при инсульте) митохондрии высвобождают кальций внутрь нейронов, что запускает процесс самоубийства клетки (апоптоз). Задача аутофагии — вовремя распознать повреждения и «поглотить» митохондрии с дефектами, не допустив гибели всей клетки.
Таким образом, практически любое заболевание нервной системы будет иметь компонент, связанный с аутофагией.
«Самоедство» — цель нейрофармакологии
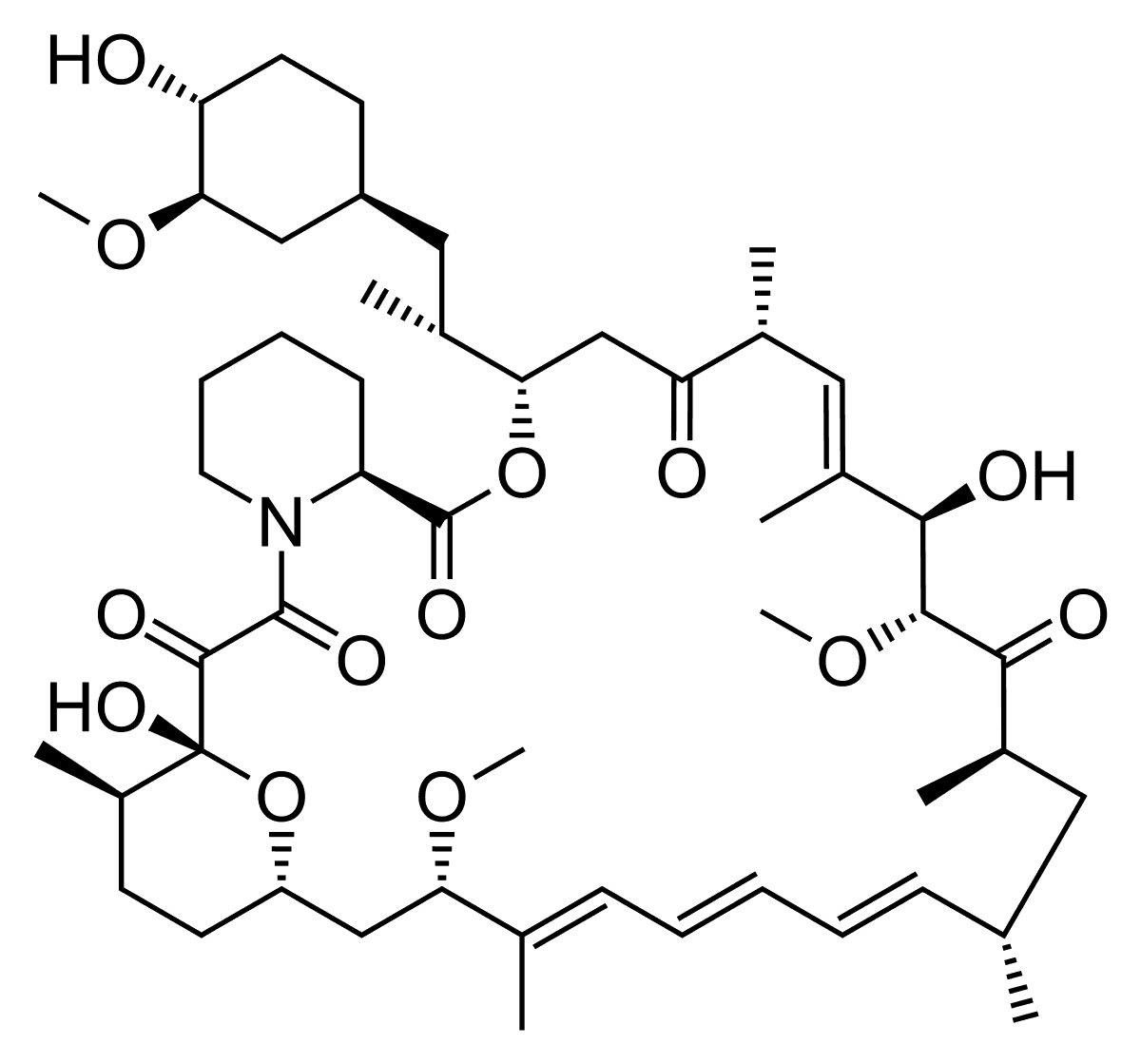
Рапамицин — вещество, которое ускоряет аутофагию. Оно применяется для лечения нейродегенеративных заболеваний. Рапамицин «разгоняет» процесс за счет того, что останавливает сигнальный путь mTOR. Проблема с этим сигнальным путём (как, впрочем, и с практически любым сигнальным путём) в его неспецифичности: помимо регуляции аутофагии у него есть и другие важные функции в организме. Соответственно, у пациентов, которые принимают рапамицин, наблюдаются побочные эффекты – снижается иммунитет, плохо заживают раны.
Риминидин, химическое соединение, которое действует более узконаправленно, в данный момент проходит клинические испытания. Также в данный момент активно тестируются и другие мишени для манипуляций со скоростью аутофагии в нервной системе.
Ключевое затруднение состоит в том, что в «деле» аутофагии, несмотря на Нобелевскую премию, остаётся ещё очень много вопросов без ответа. Трудно создать эффективное лекарство, когда не особо хорошо понимаешь, когда и что именно это лекарство должно делать. Очевидно, что вручение Нобелевской премии значительно повысит интерес к этой теме, а, значит, и увеличит финансирование подобных исследований, что вместе через какое-то количество лет всё-таки приведёт нас к созданию вожделенного лекарства от деменции.
Текст: Даша Овсянникова