Американские ученые разработали метод генетической коррекции на основе пептидонуклеиновых кислот, который в эксперименте эффективно устранил симптомы бета-талассемии у мышей. Результаты работы опубликованы в журнале Nature Communications.
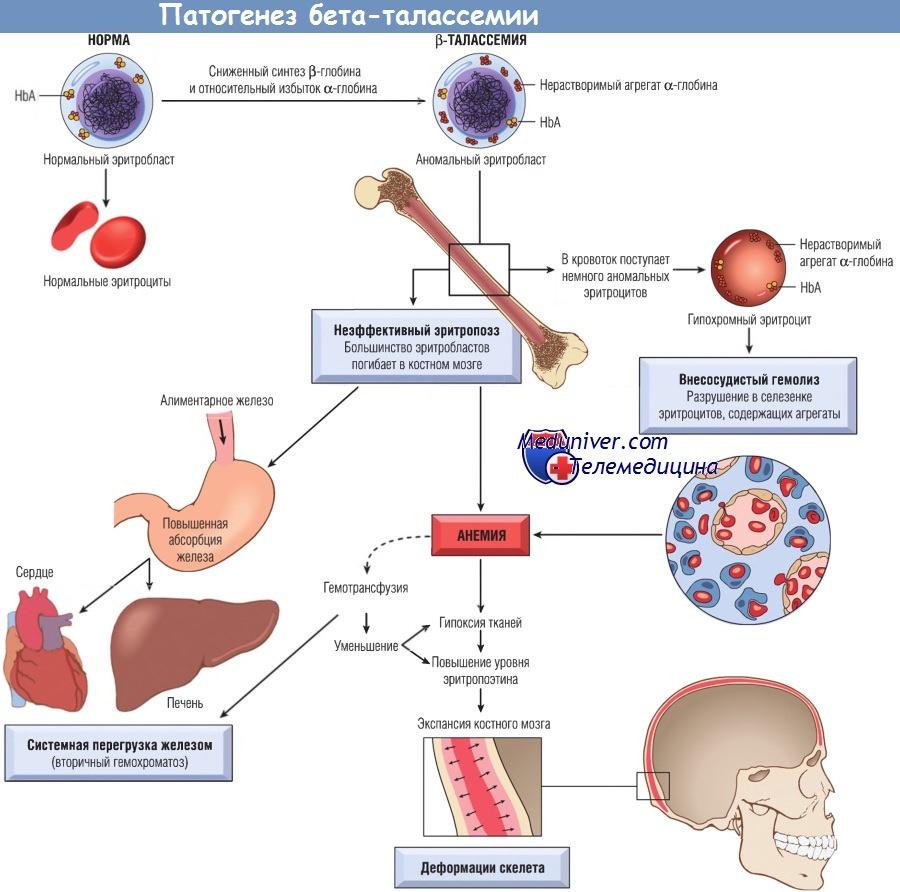
Бета-талассемия — это наследственное заболевание, при котором нарушается синтез бета-субъединицы гемоглобина (бета-глобина). Это приводит к деформации и небольшому размеру эритроцитов и снижению продолжительности их жизни, повышенному количеству ретикулоцитов (незрелых эритроцитов) в крови, анемии разной степени тяжести и увеличению селезенки (иногда в десятки раз по сравнению с нормой).
Пептидонуклеиновые кислоты (ПНК) — это синтетические аналоги нуклеиновых кислот, в которых цепь из сахара (рибозы или дезоксирибозы) и остатков фосфорной кислоты заменена полиамидной псевдопептидной последовательностью, несущей азотистые основания. ПНК в виде олигомеров способны комплементарно связываться с нуклеиновыми кислотами. В случае двухцепочечной ДНК (ДНК/ДНК) некоторые ПНК могут вытеснять одну из цепей ДНК в комплементарном участке, образуя трехцепочечную спираль (ПНК/ДНК/ПНК). В живой клетке это приводит к запуску клеточных механизмов репарации (починки) ДНК. В присутствии «здорового» фрагмента ДНК эти механизмы восстанавливают геном в соответствии с ним, что позволяет проводить коррекцию отдельных мутаций. В отличие от распространенных методов редактирования генома, например CRISPR/Cas9, этот подход не требует привлечения сторонних ферментов-нуклеаз, что снижает риск нежелательных модификаций генома.
Сотрудники Университетов Йеля, Массачусетса и Карнеги-Меллон использовали в своей работе ПНК, замещенные в гамма-положении полиэтиленгликолем (гамма-ПНК) для лучшего связывания с ДНК. Гамма-ПНК, комплементарные несущему мутацию участку гена бета-глобина, вместе с соответствующими нормальными одноцепочечными фрагментами ДНК, поместили в наночастицы из полилактида-ко-гликолида, которые обеспечивают их проникновение в кроветворные стволовые клетки (КСК).
На первой стадии экспериментов ученые убедились, что такой препарат успешно корректирует геном КСК с приводящей к бета-талассемии мутацией in vitro. Затем они выяснили, что эффективность редактирования ДНК повышается при активации клеточных сигнальных путей, связанных с тирозинкиназным рецептором с-Kit (CD117), который присутствует у кроветворных клеток.
После этого они испытали методику на трансгенных мышах с мутантным человеческим бета-глобином (у таких животных наблюдаются все типичные симптомы заболевания). Сначала мышам вводили фактор стволовых клеток (SCF), активирующий с-Kit. Спустя три часа им внутривенно ввели наночастицы с гамма-ПНК и нормальной ДНК. Процедуру повторили четырежды с интервалом в два дня.
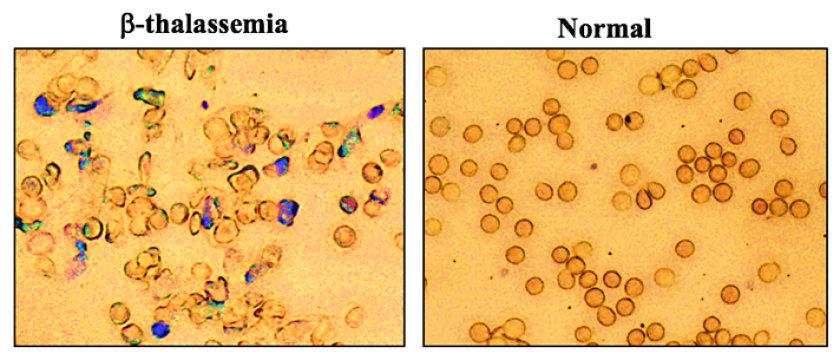
Спустя 35 дней в крови животных концентрация гемоглобина достигла нормальных значений и снизился уровень ретикулоцитов. Кроме того, у них уменьшились размеры и улучшилось гистологическое строение селезенки. Анализ ДНК показал, что уровень коррекции генома достигал семи процентов, причем побочные модификации встречались более чем в 1200 раз реже. Подобные эффекты сохранялись на протяжении 140 дней наблюдения.
Эффективность и безопасность методики подтвердили также в культуре человеческих кроветворных клеток.
«Комбинация доставки наночастицами, ПНК следующего поколения и SCF может стать минимально инвазивным и безопасным лечением генетических заболеваний крови, которое проводится путем простого внутривенного введения», — пишут исследователи. По их словам, разработанная методика подходит для лечения не только бета-талассемии, но и других наследственных гемоглобинопатий, таких как серповидноклеточная анемия.
Другим перспективным подходом к генетической модификации кроветворных клеток для лечения болезней крови, некоторых видов рака и хронических вирусных инфекций служит их генная терапия с помощью вирусного вектора, проводимая вне организма (у пациента забирают образец костного мозга, вносят в заданные клетки трансген и вводят их обратно). Недавно была разработана компактная полуавтоматическая система, которая позволяет проводить подобное вмешательство в условии медицинского учреждения без потребности в дорогостоящих лабораториях.
Автор: Олег Лищук