Больше века учёные бьются над загадкой белковых агрегатов, появление которых в мозге сопровождает развитие нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона.
Подсказка появилась всего 10 лет назад. Выяснилось, что белки в живых клетках не просто плавают в растворе. Они могут образовывать капли, подобно маслу в воде. А совсем недавно учёные из Лаборатории биологии синапсов (Институт трансляционной биомедицины СПбГУ) обнаружили, что такие капли участвуют в работе нейронов при передаче сигналов от клетки к клетке. О том, как это открытие может повлиять на понимание механизмов нейродегенерации, мы поговорили с заведующим лабораторией, профессором Олегом Шупляковым.
Впервые белковые бляшки в мозге людей, при жизни страдавших особой формой старческой деменции, были описаны в 1911 году доктором Алоисом Альцгеймером (Alois Alzheimer), чьим именем названа эта болезнь. Позже похожие образования обнаружили и у пациентов с болезнью Паркинсона (так называемые тельца Леви), боковым амиотрофическим склерозом, лобно-височной деменцией и даже травмами головного мозга. Но что заставляет нейроны, клетки нервной ткани, формировать внутри себя эти белковые глыбы? Где и как это происходит? На этот вопрос ответа не было.
Почти через 100 лет после открытия доктора Альцгеймера, в 2009 году, подсказка пришла откуда не ждали — из эмбриологии.
Открытие капель
Учёные из Института Общества Макса Планка (Дрезден, Германия) исследовали строение P-гранул в эмбрионах любимого объекта биологов — маленького почвенного червячка-нематоды C. Elegans. P-гранулы (читается «пи-гранулы») — крошечные клеточные органеллы, представляющие собой округлые включения в цитоплазме. Они появляются в незрелых яйцеклетках, перемещаются в клетки эмбриона при его развитии, а затем исчезают в соматических, то есть неполовых, клетках взрослого червячка.
Нужно сказать, что на тот момент учёным были известны два типа клеточных органелл. Окруженные мембраной — например, ядро, митохондрии, хлоропласты растений, вакуоли и везикулы. И немембранные — которые представляют собой плотные, строго упорядоченные структуры из белков и других макромолекул. Таковы, в частности, рибосомы, занятые в клетке синтезом белка.
P-гранулы удивили учёных, оказавшись не тем и не другим. Выяснилось, что эти образования из белков и РНК ведут себя в цитоплазме клетки как капли, по вязкости похожие на жидкий мед. Они меняют форму под влиянием тока окружающей их жидкости, то есть текут, а затем снова становятся круглыми. Могут сливаться друг с другом. Молекулы внутри них легко перемещаются. К тому же P-гранулы легко и быстро обмениваются веществом с цитоплазмой клетки. Всё это было бы решительно невозможно, если бы эти гранулы были окружены мембраной или представляли собой твёрдый «кусочек» белка.
Любое вещество может находиться в разных фазовых состояниях. Вода может быть паром, жидкостью или кристаллом — льдом. Точно так же биологические молекулы могут находиться в разных фазовых состояниях. Например, белки, которые в клетке обычно существуют в виде растворов, при определённых условиях формируют кристаллы. Это их свойство широко используется в кристаллографии, когда нужно определить трёхмерную структуру белковых молекул. Но одно дело — изучать структуру очищенного белка, и совсем другое — заглянуть внутрь живой клетки, чтобы узнать, как в ней ведут себя биологические молекулы.
P-гранулы впервые были описаны более 35 лет назад. Они присутствуют в эмбриональных клетках любого организма. Но с биофизической точки зрения на них взглянули, можно сказать, недавно. Фактически, исследователи взяли и надавили на одноклеточный эмбрион нематоды. И увидели, что при этом P-гранулы меняют форму, то есть проявляют свойства жидкости. Что значит «увидели»? Заставили их светиться, «пришив» к их белковой составляющей зелёный флуоресцентный белок — GFP. Перемещение молекул внутри гранул исследовали с помощью технологии FRAP (fluorescence recovery after photobleaching — восстановление флуоресценции после фотообесцвечивания. — прим. автора). Эта технология сегодня встроена во многие конфокальные микроскопы. Вы можете нацелить микроскоп на участок клетки, где присутствуют молекулы, помеченные GFP, задать его размеры и иногда даже форму и обесцветить. После этого вы сможете изучать, как другие меченые молекулы, если они подвижны, туда приходят и восстанавливают «пробел».
Давайте разделимся
Звучит просто, но эти технологии стали широко доступны только в середине 1990-х годов. Весь XX век подобные открытия были просто невозможны. Результаты же исследования P-гранул заставили многих учёных обратить внимание на образование в клетках молекулярных конденсатов. Так были названы капли, ведь белки при их формировании конденсируются из цитоплазмы клетки, как пары воды из воздуха выпадают росой на листья растений. В течение следующих лет выяснилось, что молекулярными конденсатами, хоть и разными по составу и вязкости, являются многие структуры в живых клетках, чья природа раньше была не ясна. Например, ядрышки — уплотнения внутри клеточного ядра, где происходит синтез частей рибосом. Центросома (клеточный центр) — место образования микротрубочек, главных элементов клеточного скелета. Стрессовые гранулы — скопления РНК и белков, которые образуются в клетке под влиянием вредных факторов: высоких температур, токсинов, ультрафиолета. Список можно продолжать, но суть в том, что всего за десяток лет научный взгляд на устройство клетки кардинально изменился. Оказалось, что почти всё содержимое клетки можно представить как постоянно образующиеся и снова растворяющиеся молекулярные конденсаты. А возможно это потому, что клеточные белки способны формировать поверхность раздела фаз. То есть отделяться от жидкого содержимого клетки, при этом тоже оставаясь жидкими.
Что такое поверхность раздела фаз между двумя жидкостями, проще всего пояснить на бытовом примере. Если мы нальём немного масла в воду и взболтаем, то масло разобьётся на отдельные шарики-капельки, но с водой не смешается. Это происходит потому, что молекулы воды и молекулы масла обладают разными свойствами. Молекулы воды полярны. Атом кислорода в них несёт на себе частичный отрицательный заряд, атомы водорода — положительный. Таким молекулам удобно находиться в компании друг друга: водород одной молекулы притягивается к кислороду соседней по закону разноимённых зарядов. А вот молекулы масла неполярны, никаких заметных зарядов у них нет. И, когда молекулы воды устремляются друг к другу, они просто выталкивают чужаков из своей уютной компании.
Порядок из беспорядка
Молекулярные конденсаты, подобные P-гранулам, образованы не жирами, а белками — молекулами куда более сложными и разнообразными по строению. Не все из них в принципе могут конденсироваться таким способом, а те, что могут, делают это лишь в определённых условиях. Капли формируются где и когда это нужно клетке.
Первичная структура белка — это цепочка аминокислот, различных по строению и свойствам. Одни несут на себе положительный заряд, другие отрицательный, третьи нейтральны. Поэтому после синтеза эта цепочка недолго остаётся просто цепочкой. Разноимённые заряды в молекуле притягиваются, одноимённые отталкиваются, нейтральные аминокислоты вынужденно оказываются в компании друг друга, подобно маслу в воде. И цепочка сворачивается в спираль или плоский лист. Это вторичная структура белка. Спирали и листы складываются в более сложные фигуры — фибриллы (нити) и глобулы (шары).
Но когда белок складывается, активные части аминокислот (боковые цепи) оказываются погребены внутри свернувшейся молекулы и не способны к взаимодействию с другими молекулами. Однако может случиться так, что аминокислотная последовательность всей цепочки или её части не даёт ей свернуться. Боковые цепи остаются открытыми и могут вступить в контакт с другой молекулой белка. Такие участки белковых молекул называются «неупорядоченными» (intrinsically disordered regions — IDR). Именно они позволяют молекулам «примагничиваться» друг к другу за счёт электростатического взаимодействия и формировать поверхность раздела фаз.
Сегодня существуют компьютерные программы, способные по аминокислотной последовательности предсказать уровень неупорядоченности белка, его конкретного участка. Белковые капли в клетках состоят из множества компонентов. С ходу невозможно сказать, какой именно белок в составе капли формирует поверхность раздела фаз. С помощью программы, анализирующей аминокислотную последовательность белков, можно выявить белки-кандидаты. Для экспериментов белки метятся флуоресцентной меткой, чтобы их можно было видеть под микроскопом. Такие «усовершенствованные» белки могут выращиваться в бактериях, дрожжах, или в специальных клетках и затем выделяться в чистом виде. Искусственно возможно получать не только белок целиком, но и отдельные его участки, в том числе IDR. Таким образом учёные могут исследовать свойства белка в пробирке и определить, действительно ли он образует капли, при каких условиях, и исследовать их свойства.
Жонглирование «пробирками»
Зачем вообще клеткам нужны эти белковые капли? Это быстрый способ «огородить» место внутри клетки для протекания какого-нибудь биохимического процесса или хранения веществ. Капли могут быть устроены довольно сложно. Поверхность раздела фаз образует один белок, но внутри могут находится другие белки, РНК, даже целые органеллы. Так, клеточный центр, имеющий «капельное» строение, содержит внутри центриоли — два плотных цилиндра из микротрубочек, которые играют важную роль в делении клетки. При этом условия внутри капли отличаются от условий в окружающей среде. Например, в ней может поддерживаться повышенная концентрация каких-то веществ. Сила поверхностного натяжения, возникающая на границе капли, не даёт пройти внутрь крупным белковым комплексам — а значит её содержимое защищено от действия большинства ферментов. Проще говоря, капли, способные конденсироваться и растворяться за доли секунды — это такие «пробирки», которые у химика-природы всегда под рукой.
Клетка ловко управляет образованием капель. Для этого у неё есть несколько инструментов. Дело в том, что структуру белков, в том числе ту, которая позволяет ему формировать капли, можно менять. Во-первых, белки весьма чувствительны к действию температуры. Даже при небольших её повышениях и понижениях они способны обратимо менять свою структуру. Также на форму, принимаемую белковой молекулой, влияет кислотно-щелочной баланс (pH). Но тоньше всего «настраивать» белок можно, меняя свойства аминокислот, входящих в его состав. Например, присоединяя к некоторым из них фосфатную или метильную группу. Такой химической модификацией белков в клетке занимаются другие белки: ферменты протеинкиназы и метилазы.
Взаимодействие с другими молекулами внутри клетки, не являющимися ферментами, — белками, РНК, ДНК — также способно повлиять на способность белка образовывать капли или изменять их физические свойства.
Ещё один важный инструмент — это концентрация белка. Чтобы образовать каплю, молекулы белка должны встретиться друг с другом. Но клетка маленькая, и, хотя в ней одновременно находится множество разных веществ, молекул одного и того же белка там может быть совсем немного. Тут в игру вступает эффект молекулярной скученности. Другие большие молекулы, не участвуя во взаимодействии интересующего нас белка, занимают в клетке пространство, оттягивают на себя молекулы воды и буквально подталкивают белки будущих капель к контакту. Это похоже на встречу двух старых знакомых в метро. В пустом вагоне они, может быть, и не узнали бы друг друга или постеснялись бы подойти. Но в час пик, будучи притёртыми чужими спинами и сумками так, что оказались лицом к лицу, они уже не могут не сказать «Привет!».
Хрупкий баланс
Все эти факторы — температура, pH, локальная концентрация, химическая модификация, взаимодействие с другими молекулами — используются клеткой для управления каплями. Получается довольно сложная система. А чем сложнее система, тем она уязвимей к разного рода поломкам. Неисправности в системе регуляции белковых капель грозят тем, что белки в них не удержатся в жидком состоянии и начнут образовывать твёрдые частицы.
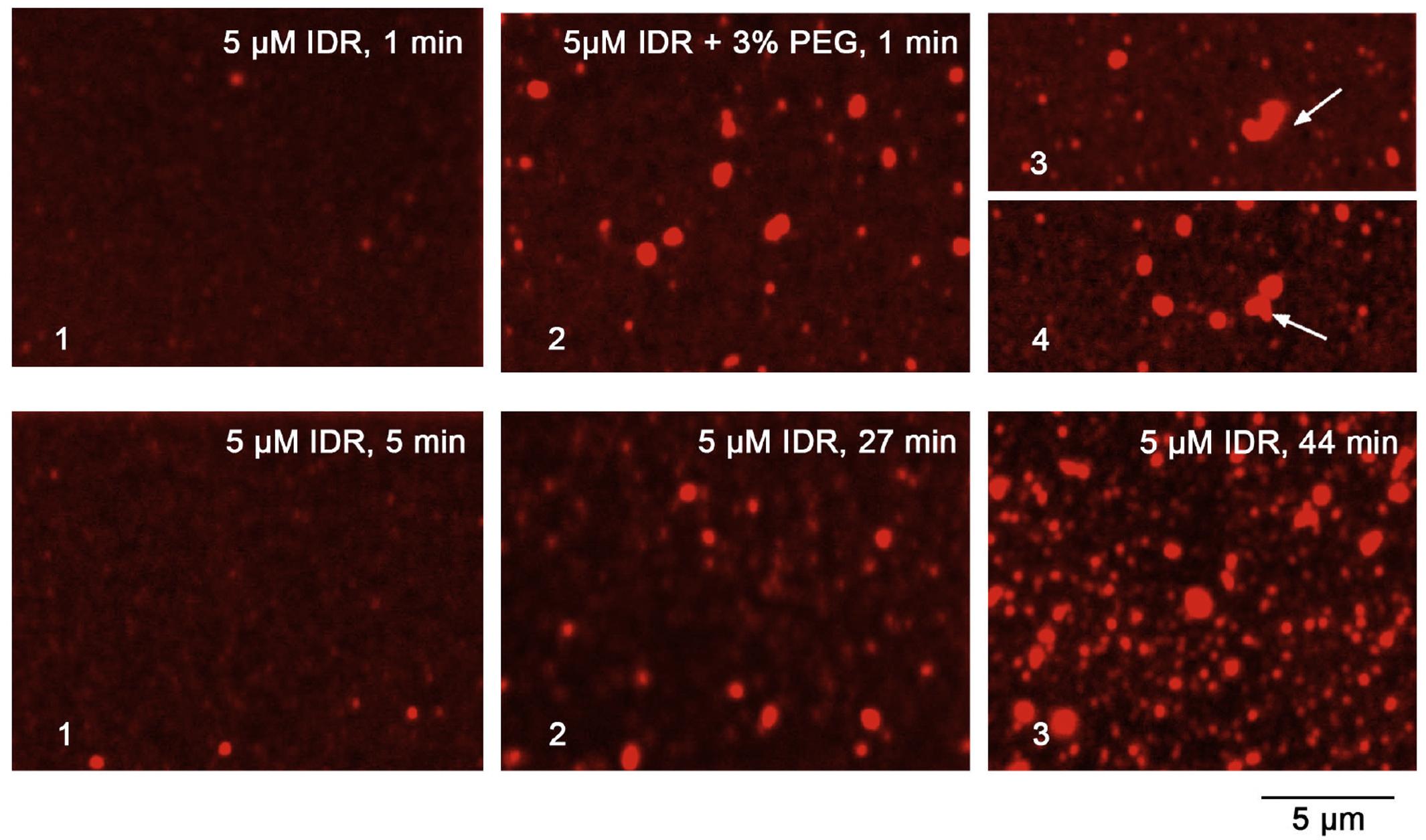
В экспериментах с фотообесцвечиванием обнаружили, что при восстановлении капель в жидкой фазе иногда могут образовываться твёрдые агрегаты. Часто эти агрегаты имеют форму филаментов. Происходит это потому, что белковые молекулы, имеющие IDR, переходят через определённый концентрационный барьер, при котором жидкая фаза нарушается. Если нарисовать график зависимости фазовых состояний таких белков от концентрации, то в начале мы обнаружим участок, где белок будет преимущественно находиться в виде раствора, затем — в жидкой конденсированной фазе, а далее он переходит в плотный гель и твёрдые агрегаты. Этот переход в твёрдое состояние необратим. Концентрационный барьер, отделяющий его от жидкой фазы называется по-английски glass/gel boundary barrier.
Вскоре возникло обоснованное предположение, что именно так происходит образование белковых бляшек и филаментов при нейродегенеративных болезнях. В частности, в белковых агрегатах из мозга людей, страдавших лобно-височной деменцией и боковым амиотрофическим склерозом обнаружены компоненты стрессовых гранул. Выяснилось, что генетические мутации, часто встречающиеся при этих болезнях, меняют свойства белка гранул так, что он даже в условиях пробирки (in vitro) становится склонен переходить из жидкого состояния в твёрдое. Такие переходы в лабораторных условиях продемонстрированы и для нескольких белков, давно известных учёным именно связью с нейродегенеративными заболеваниями. В частности, для тау-белка, образующего клубки в мозге при болезни Альцгеймера, для хантингтина, главного маркера болезни Хантингтона, и для альфа-синуклеина, основного белка болезни Паркинсона.
Когда обрывается связь
Но чтобы понять, как развивается болезнь и как её остановить, мало знать, что патологический белок может переходить в твёрдое состояние из жидкого. Нужно ответить на целый ряд вопросов. Где в норме образуется его жидкая фаза? С какими белками он при этом «сотрудничает»? И, собственно, почему нейрон теряет контроль над своими молекулярными конденсатами? Именно на эти вопросы применительно к болезни Паркинсона пытаются ответить учёные из Лаборатории биологии синапсов СПбГУ при поддержке Российского Научного Фонда (РНФ).
Синапс — это место контакта между двумя нейронами, через которое эти клетки общаются друг с другом. В нём можно выделить пресинаптическую часть от передающего нейрона и постсинаптическую часть от нейрона, получающего сообщение. Пресинаптическая часть располагается на конце длинного отростка нейрона — аксона, который, как провод, может связывать две даже очень удаленные друг от друга нервные клетки. Такие отростки с синапсами на концах тянутся и из чёрной субстанции среднего мозга в стриатум (иначе — полосатое тело). Чёрная субстанция состоит в основном из нейронов, использующих в качестве сигнальной молекулы при общении с соседями дофамин. Одна из главных функций этих нейронов — регуляция мышечного тонуса и движений. При болезни Паркинсона синаптические связи нейронов чёрной субстанции с другими отделами мозга, в частности, со стриатумом, нарушаются. У человека появляются характерные симптомы — шаткость походки, аномальное напряжение мышц, дрожание рук. В большинстве случаев это связано с гибелью дофаминергических нейронов. Точные причины их гибели до конца не выяснены. Одним из характерных проявлений патологии являются тельца Леви. Эти токсичные белковые агрегаты, состоящие в основном из альфа-синуклеина, накапливаются в дофаминергических нейронах незадолго до их гибели. В нормальных условиях этот белок работает в пресинаптических окончаниях. Он участвует в управлении циклом синаптических пузырьков, содержащих дофамин и выделяющих этот нейропередатчик наружу, когда клетка передает сигнал.
Капля-передатчик
Что удалось выяснить учёным под руководством Олега Шуплякова — так это то, что в работе пресинаптического окончания и в передаче сигнала между нейронами важную роль играют белковые капли.
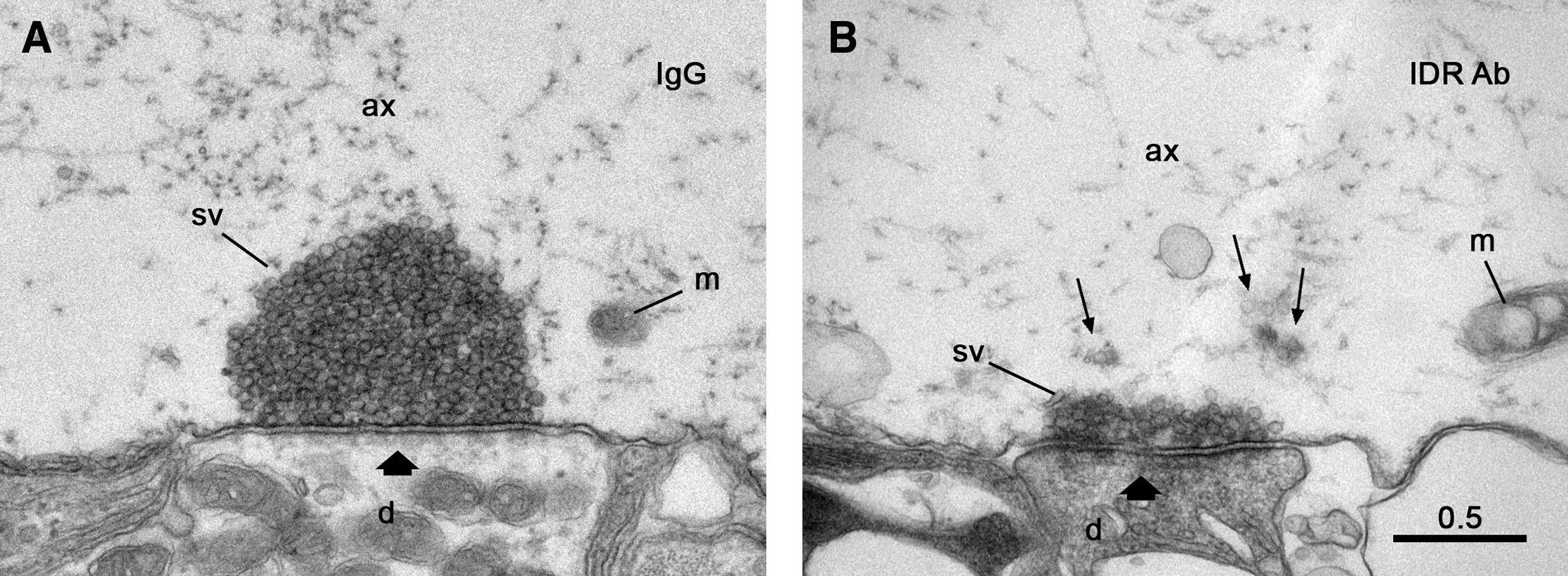
Если посмотреть на пресинаптическую часть нейрона в электронный микроскоп, то мы увидим, что там находится огромное число пузырьков-везикул. Они содержат вещества-нейротрансмиттеры. Основной белок, который организует эти пузырьки в компактный кластер, такую «шапочку» прямо над зоной контакта между клетками, называется синапсин 1. Он принадлежит к небольшому семейству белков, которые у человека, в частности, кодируются тремя различными генами. Каждый раз, когда нейрон передаёт сигнал, синапсин отпускает часть пузырьков. Они сливаются с мембраной клетки, и нейротрансмиттер выходит наружу. Целый ряд других белков также участвуют в этом процессе, в частности альфа-синуклеин.
Долгое время существовала гипотеза, что синапсин удерживает везикулы в кластере, прикрепляя их к актиновым филаментам — частям клеточного скелета. Но у этой гипотезы были слабые места. Например, некоторые исследования показали, что актиновых филаментов попросту нет внутри кластера. В то же время, когда аминокислотную последовательность синапсина 1 изучили с помощью компьютерных алгоритмов, оказалось, что его «хвостик» образует неупорядоченный участок — IDR. И если этот участок получить отдельно, то in vitro он образует те самые капельки. Стимулировать процесс можно увеличением концентрации белка или добавлением полиэтиленгликоля — вещества, которое в пробирке создаёт условия молекулярной скученности.
Но если синапсин образует жидкую фазу за счёт взаимодействий между IDR, значит её можно разрушить, воздействуя на эти участки. Именно это мы и сделали в своём исследовании. Причём, помимо исследований in vitro, мы провели эксперименты на живых нейронах, живых синапсах миноги. Миноги — это бесчелюстные рыбы, паразитирующие на других рыбах. Как модельная система для исследования синапсов они интересны из-за особенностей физиологии.
Дело в том, что, как правило, у всех позвоночных аксоны очень тонкие. На концах они ещё и ветвятся. И обычный размер синапсов, расположенных на концах этих веточек, — не больше 3—4 микрон. Туда сложно «забраться». А у миног в спинном мозге есть гигантские аксоны. Они не ветвятся, а идут как магистральные трубы, к которым на разных участках подходят принимающие сигнал отростки других нейронов — дендриты. В этих местах образуются синаптические соединения. Внутрь таких гигантских аксонов можно добраться микроэлектродом и воздействовать на белки, управляющие организацией синаптических пузырьков, с помощью микроинъекций активных веществ.
Мы ввели в живой синапс, находящийся в состоянии покоя, когда сигнала нет, фрагмент другого белка, который взаимодействовал с IDR синапсина и мешал его молекулам притягиваться друг к другу. Выяснилось, что после инъекции этого агента пузырьки в синапсе буквально «разлетаются» в разные стороны, они не могут больше удерживаться на месте. То есть пузырьки действительно группируются с помощью жидкой фазы, которую создает синапсин.
Какое это имеет отношение к болезни Паркинсона? Последние исследования показали, что при болезни Паркинсона патологические агрегаты может образовывать альфа-синуклеин вместе с синапсинами. То есть развитие болезни может начинаться с нарушения каких-то механизмов в пресинаптическом окончании, где эти белки взаимодействуют друг с другом. Это открывает новые перспективы для понимания механизмов возникновения патологических белковых агрегатов в нейронах и поиска молекулярных мишеней для лечения болезни.
К сожалению, на сегодняшний день не существует методов ранней диагностики болезни Паркинсона. Чаще всего диагноз ставится, когда больше половины дофаминергических нейронов чёрной субстанции уже погибли. Препараты, которые применяются для терапии, например, Леводопа — биологический предшественник дофамина, могут лишь на некоторое время уменьшить проявления заболевания. Понимание процессов, которые начинают происходить в нейронах задолго до появления внешних симптомов, сделает возможным поиск лекарств, которые способны действительно остановить болезнь.
Подготовка материала: Наталья Нифантова