Этому вопросу посвящен обзор литературы, вышедший недавно в журнале Chinese Medical Journal. В нем авторы освещают все, что на данный момент известно о лечебном действии света при нейродегенеративных заболеваниях – болезни Альцгеймера и болезни Паркинсона.
С каждым годом исследователи все глубже погружаются в патофизиологию развития нейродегенеративных заболеваний. Но, к сожалению, даже в этих условиях пока адекватных способов их лечения не существует. В крайнем случае неврологи могут предложить пациентам с болезнью Паркинсона заместительную терапию, восстанавливающую уровень дофамина в мозге, а пациентам с болезнью Альцгеймера – препараты, которые немного затормаживают прогрессирование деменции.
В этом свете разработка новых методов лечения выглядит крайне перспективно. В последние годы нейробиологи обратились к физическим методам воздействия – различным видам стимуляции (магнитной, электрической), звуку, свету и другим способам повлиять на развитие патологии внутри мозга. Многие работы указывают на то, что здесь эффективной может оказаться световая терапия, и китайские исследователи решили объединить их в как можно более полный обзор.
Авторы отмечают, что светотерапия – не забавный новый экспериментальный метод воздействия на организм человека, но вполне уже зарекомендовавший себя при некоторых психических нарушениях и расстройствах сна. Однако, данных о его возможностях при нейродегенерациях недостаточно.
Световая терапия включает в себя контролируемое воздействие естественного света или искусственного света с определенной длинной волны. Протоколы лечения могут быть совершенно разными в зависимости от клинической ситуации – от нескольких минут до нескольких часов в день. При этом воздействие может осуществляться как через нервный путь, связывающий сетчатку глаза с гипоталамусом (главным вегетативным центром регуляции мозга), так и напрямую через кости черепа – например, с помощью шлема, излучающего инфракрасный свет.
Один из методов влияния светотерапии, описываемый авторами, как раз связан с циркадными ритмами или биологическими часами. Их работа построена на информации об освещенности, которая поступает из сетчатки в определенные ядра (скопления нейронов) гипоталамуса.
Гены, которые экспрессируются этими нервными клетками, имеют решающее значение для поддержания циркадного ритма. Нарушение же их работы приводит к нарушению биологических часов и связано с нейродегенеративными процессами, расстройствами обмена веществ и сна. И внешние раздражители, такие как свет, физическая активность или прием пищи, могут помочь «сбросить» часы и восстановить нормальные циркадные ритмы, облегчая тем самым симптомы.
Другой путь, по которому можно влиять на мозг светом, связан с выработкой гормона мелатонина, который также относится к циркадной системе. Но световое воздействие на шишковидную железу, в которой мелатонин вырабатывается, например, в дневное время может устранить патологическую сонливость, которая периодически наблюдается у пациентов с нейродегенерациями.
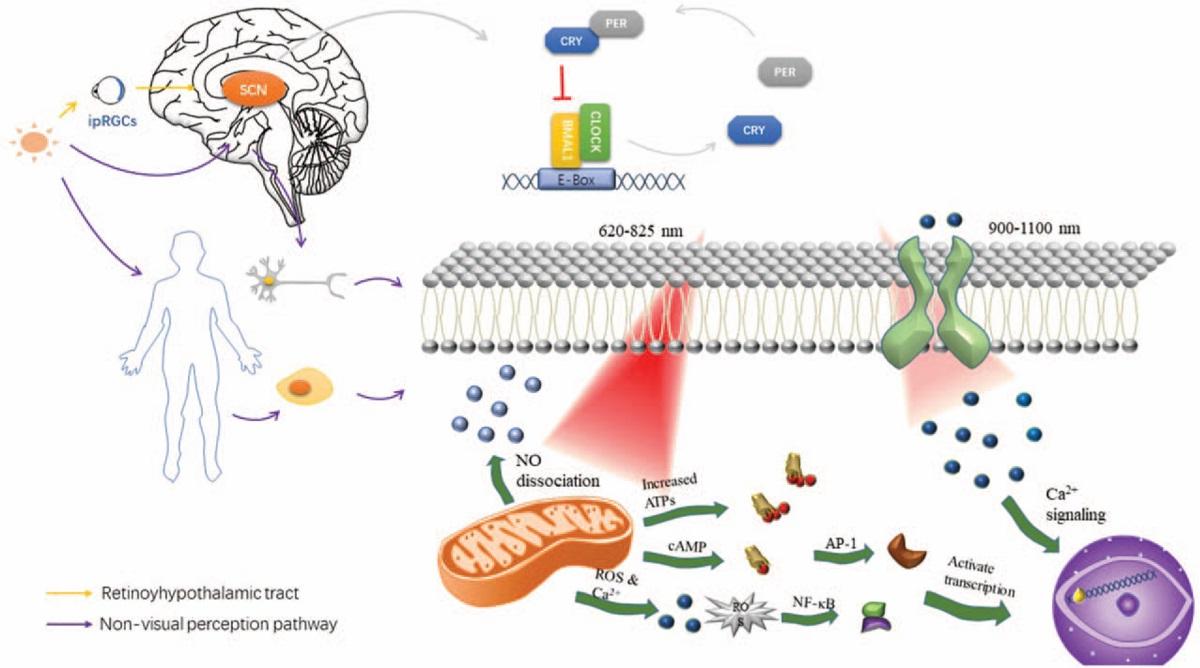
Ученые рассматривают и иные механизмы, не связанные со зрительным восприятием. Эксперименты на животных показывают, что освещение туловища тоже может оказывать нейропротективный эффект. Конкретные механизмы, лежащие в основе этого эффекта, называемого дистанционной (транскраниальной) фотобиомодуляцией, не совсем ясны. Но вполне вероятно, что свет активирует одну или несколько молекул или клеток в организме, например, иммунные клетки, медиаторы воспаления или стволовые клетки костного мозга. Эти клетки предположительно восстанавливают функции нейронов, высвобождая факторы роста нервов (NGF) или нейротрофические факторы мозга (BDNF).
Разные источники света имеют разные длины волн, которые поглощаются, отражаются или рассеиваются различными клеточными органеллами. Каждый конкретный хромофор реагирует на определенный диапазон длин волн. Например, для красного и ближнего инфракрасного (NIr) света цитохромоксидаза, последний фермент в дыхательной цепи митохондрий – это основной фоторецептор и играет жизненно важную роль в механизме фотобиомодуляции. Цепь реакций с участием NO (то есть его фотодиссоциации) приводит к повышению потенциала митохондриальной мембраны и потребления кислорода. Устанавливается протонный градиент, что в конечном итоге приводит к увеличению производства АТФ.
Есть и иная гипотеза. Исследователи предполагают, что существует особая сигнальная система между митохондриями клеток из разных систем органов. Согласно этой теории, митохондрии при стрессе выделяют еще не идентифицированную сигнальную молекулу, называемую митокином, которая запускает митохондриальную стрессовую реакцию в других областях тела. Интересно, что свет с длинами волн больше, чем спектр NIr, например 980 нм, 1064 нм или 1072 нм, по-видимому, способен оказывать влияние на биологические ткани или клетки. Это говорит о том, что наверняка существуют и другие хромофоры помимо цитохромоксидазы.
Далее авторы обсуждают воздействие света на мозг при болезнях Альцгеймера (БА) и Паркинсона (БП). У пациентов с БА часто бывает спутанность сознания, эмоциональный дистресс и гиперактивность после сумерек и в течение ночи. Предварительные клинические исследования на животных моделях, а также на пациентах с БА показывают, что световая стимуляция помогает восстанавливать память и познавательные способности, а также способна снижать содержание β-амилоида в головном мозге. Кроме того, она может улучшать качество и продолжительность сна у таких людей, что тоже способствует улучшению симптомов при деменции.
Бессонницу с помощью светотерапии лечат и при БП, а помимо нее облегчаются симптомы депрессии и хронической усталости, которые ухудшают качество жизни пациентов. Кроме того, в случае БП люди страдают от двигательных нарушений, тремора и дисбаланса позы, на которые тоже пытаются воздействовать светом. Но доказательства его прямого воздействия на моторную функцию ограничены. В прошлом году во Франции запустили клиническое испытание, которое должно установить, реально ли свет способен помочь при моторных нарушениях на ранней стадии БП.
Использование светотерапии при других нейродегенеративных заболеваниях в настоящее время находится на доклинических стадиях и требует дальнейшего изучения. В целом же она представляет собой многообещающую безопасную и экономичную альтернативу имеющемуся сейчас дорогому и не всегда эффективному лечению нейродегенераций.
Однако авторы делают акцент на том, что все-таки есть еще очень много деталей, которые требуют значительно большего количества доказательств. И необходимы дальнейшие исследования для определения задействованных механизмов, а также рандомизированные слепые клинические испытания – для определения эффективности светолечения при деменциях.
Текст: Анна Хоружая
