Американские, канадские и французские исследователи провели серию экспериментов на мышах и обнаружили в вентральной префронтальной коре мозга популяцию атипичных глутаматергических нейронов, отвечающих за переключение между подкрепляющим и вызывающим отвращение эффектом опиоидов.
Действие опиоидов на систему вознаграждения мозга во многом обусловлено стимуляцией ингибирующих мю-опиоидных рецепторов в ГАМКергических нервных окончаниях, тормозящих активность дофаминергических нейронов вентральной области покрышки мозга (VTA). В результате этого усиливается дофаминергическая передача в прилежащем ядре и других компонентах мезолимбической системы, отвечающих за чувство удовольствия и подкрепления. Мю-опиоидные рецепторы присутствуют и в некоторых других структурах мозга, где дофаминовые рецепторы отсутствуют, но они изучены гораздо меньше. Наблюдения показывают, что прием опиоидов в стандартных дозах может парадоксальным образом вызывать не подкрепление, а отвращение. Механизмы подобного эффекта практически неизвестны, при этом он может играть значительную роль в развитии злоупотребления опиоидами и зависимости от них.
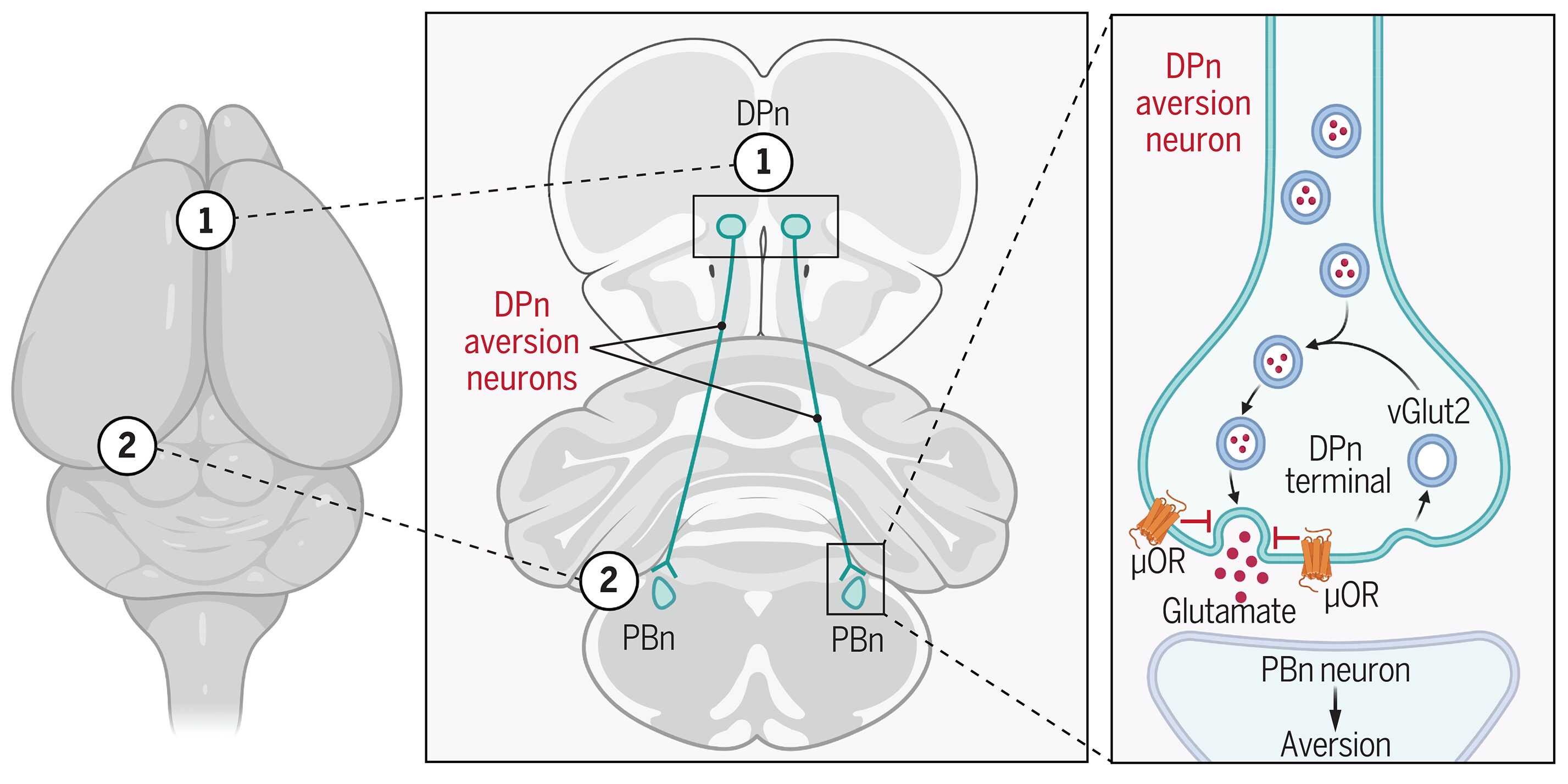
Чтобы изучить их, Пол Кенни (Paul Kenny) из Медицинской школы имени Айкана с коллегами из Канады, США и Франции начал с того, что вводил мышам опиоид оксикодон или физиологический раствор и провел картирование всего мозга по белку c-Fos — раннему маркеру возбуждения нейронов. Это позволило идентифицировать 28 участков мозга с высокой плотностью мю-опиоидных рецепторов, включая дорсальное педункулярное ядро (DPn) — практически неисследованную область вентральной префронтальной коры, на которой исследователи остановили дальнейшее внимание.
Они использовали FosTRAP2-мышей с оптогенетическим конструктом для прицельной оптической стимуляции только тех нейронов DPn, активность которых возрастала после инъекции оксикодона. При их стимуляции мыши начинали избегать приема препарата, то есть, вероятно, DPn участвует в регуляции негативной реакции на опиоиды. Отслеживание аксонов этих нейронов по всему мозгу с помощью флуоресцентных меток показало, что они иннервируют нейроны парабрахиальных ядер (PBn) — структур, которые участвуют в угнетении дыхания и других физиологических реакциях на введение опиоидов, а также в их избегании. Картирование коннектома отдельных клеток методом MAP-Seq подтвердило это и показало, что многие из них также имеют проекции в VTA.
Пространственный транскриптомный анализ клеток DPn и окружающих участков коры позволил выявить в этом ядре редкую популяцию пирамидных нейронов, экспрессирующих везикулярный глутаматный транспортер 2 (нейроны DPnvGlut2), характерный для подкорковых глутаматергических нейронов. Отслеживание их аксонов показало, что эти нейроны проецируются в PBn, а их оптическая стимуляция вызывала избегающее поведение, обратимое инъекцией оксикодона. Секвенирование РНК ядер отдельных клеток и флуоресцентная гибридизация in situ определили, что DPnvGlut2 нейроны экспрессируют мю-опиоидные рецепторы (в коре мозга они характерны для тормозных ГАМКергических интернейронов, а не возбуждающих глутаматергических).
Электрофизиологическая регистрация активности DPnvGlut2 нейронов показала, что опиоиды снижают их возбудимость. При этом оптическая стимуляция их окончаний усиливала глутаматергическую возбуждающую импульсацию в PBn, а опиоиды ингибировали ее. Генетический нокаут мю-опиоидных рецепторов в нейронах DPn не влиял на локомоторный стимулирующий эффект оксикодона (медиатором которого служит мезолимбическая система), однако вызывал у мышей избегание препарата (от которого в присутствие этих рецепторов они получали удовольствие). Дополнительные эксперименты показали, что стимуляция DPnvGlut2 нейронов усиливает проявления синдрома отмены у зависимых от опиоидов мышей, а выключение этих клеток ослабляет подобные симптомы.
Таким образом, популяция глутаматергических нейронов DPn, экспрессирующих мю-опиоидные рецепторы и иннервирующих PBn, служит ключевым регулятором реакций подкрепления и избегания при приеме опиоидов, которые лежат в основе склонности к формированию и закреплению опиоидной зависимости, заключают авторы работы.
Отчет о работе опубликован в журнале Science.
Ранее британские исследователи проанализировали активность отделов мозга у добровольцев и пришли к выводу, что за склонность к зависимости от психоактивных веществ и устойчивость к ней отвечает сила функциональных связей между вентромедиальной частью хвостатого ядра (одной из структур системы вознаграждения мозга) и разными частями префронтальной коры.
Автор: Олег Лищук