Болезнь Альцгеймера на протяжении десятилетий оставалась одной из самых сложных задач современной медицины. Однако последние годы оказались более продуктивными, даже, как отмечают авторы, прорывными.
Статья, опубликованная в журнале Nature, подводит итоги этих достижений и обрисовывает новую парадигму понимания и лечения этого нейродегенеративного заболевания.
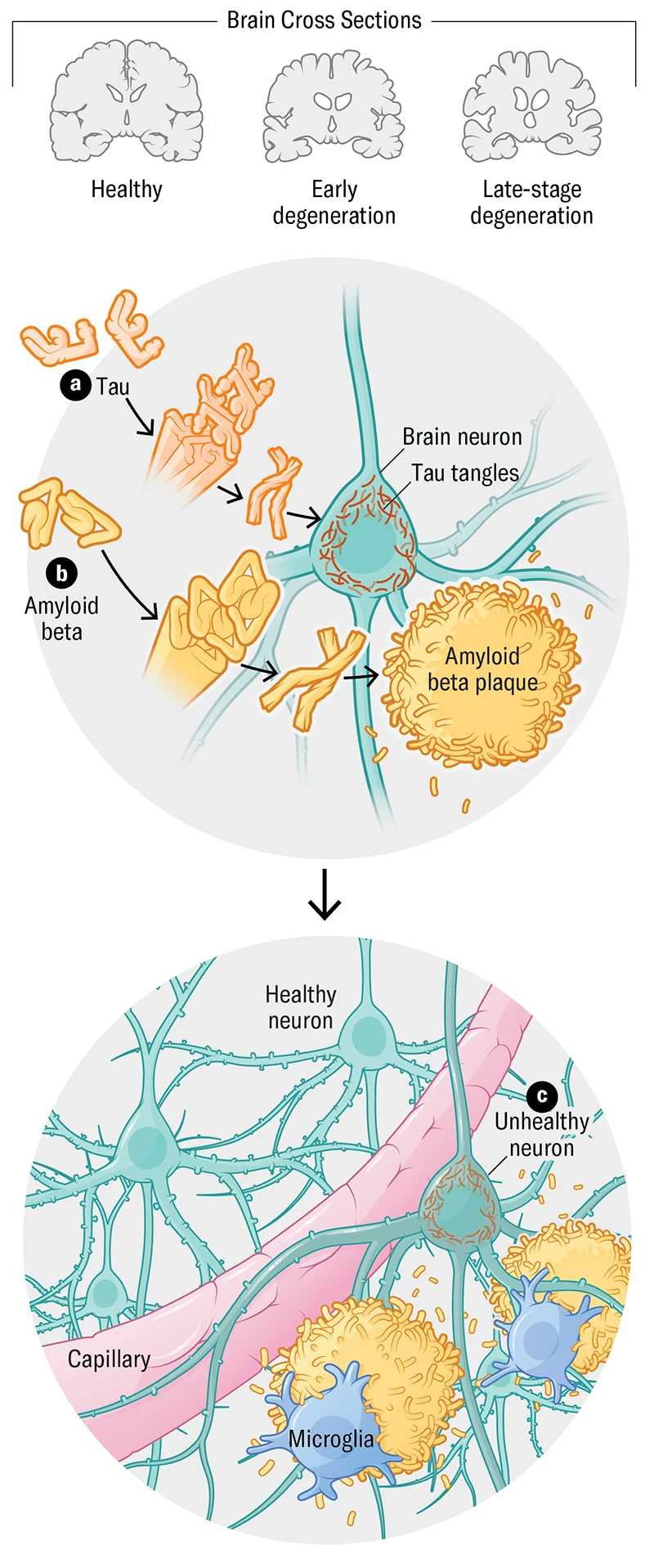
Традиционно болезнь Альцгеймера ассоциировалась с двумя ключевыми патологическими признаками: внеклеточными бляшками из белка бета-амилоида и нейрофибриллярными клубками тау-белка, которые накапливаются внутри нервных клеток. Эти структуры повреждают нейроны, нарушают межклеточную коммуникацию и в конечном итоге приводят к гибели клеток.
Однако все чаще ученые сталкиваются с тем, что наличие амилоидных бляшек не всегда коррелирует с развитием болезни. Например, согласно одному из исследований, менее чем у четверти когнитивно здоровых 75-летних женщин с положительным результатом на бета-амилоид развивается болезнь Альцгеймера в течение жизни. Это указывает на то, что этот белок – лишь один из компонентов сложной патогенетической цепи, а не единственный двигатель прогрессирования болезни.
На начало 2025 года ведется разработка 138 фармакологических препаратов, участвующих в 182 клинических испытаниях. Наиболее часто в качестве мишеней выступают рецепторы нейромедиаторов, сам бета-амилоид, воспаление и иммунные процессы. Однако помимо этих направлений активно исследуются и другие: влияния на тау-белок, синаптическую пластичность, метаболизм, сосудистую систему, факторы роста, эпигенетику, нейрогенез, окислительный стресс и протеостаз.
Одним из ключевых белков при болезни Альцгеймера считается TNF-α – белок, существующий в растворимой и мембранно-связанной формах (то есть внутри клеточных мембран). При хроническом воспалении преобладает растворимая форма, которая нарушает гомеостаз и усиливает нейродегенерацию. Компания INmune Bio разрабатывает препарат, который нейтрализует именно растворимый TNF-α, восстанавливая защитные функции его мембранно-связанной формы.
Ген APOE имеет три основные аллельные формы: ε2, ε3 и ε4. Наличие двух копий ε4 увеличивает риск развития болезни Альцгеймера до 25 раз по сравнению с генотипом ε3/ε3. Компания Lexeo Therapeutics провела пилотное исследование генной терапии с использованием модифицированных вирусов. Пятнадцати пациентам с генотипом APOE ε4/ε4 был доставлен ген APOE ε2. Целью терапии стала экспрессия «защитного» варианта белка.
Нарушения метаболизма глюкозы в мозге – еще один признак болезни Альцгеймера. В исследовании Университета Уэйк Форест тестируется интраназальное введение инсулина в сочетании с препаратом для лечения диабета – эмпаглифлозином – у пациентов с легкими когнитивными нарушениями или на ранней стадии болезни Альцгеймера. Инсулин через обонятельные и тройничные нервы попадает напрямую в мозг, где может улучшать энергетический метаболизм, нейропластичность и сосудистую функцию.
Также повреждение гематоэнцефалического барьера и сосудистая дисфункция могут предшествовать появлению амилоидных бляшек. Компания Neuvasq разрабатывает антитела, направленные на укрепление барьера и замедление прогрессирования болезни. Параллельно Roche работает над новым антителом – тронтинемабом, способным эффективнее проникать через ГЭБ для борьбы с амилоидом и тау-белком.
Современное понимание болезни Альцгеймера выходит далеко за рамки классической амилоидной гипотезы. Все большее значение приобретают глубокое изучение воспаления, иммунных нарушений, метаболических дисфункций, генетических факторов, повреждения гематоэнцефалического барьера и сосудистых рисков для разработки более эффективных методов лечения болезни Альцгеймера.
Текст: Иван Долгих