Одно из доклинических проявлений таких нейродегенеративных заболеваний, как болезнь Альцгеймера и лобно-височная деменция – это нарушение работы сосудов головного мозга. Однако, остается открытым вопрос, становится ли это причиной нейродегенерации или же ее следствием.
Ученые из США провели исследование на мышах, склонных к нейродегенеративным заболеваниям, и выяснили, что токсичный белок нарушает работу кровотока в мозге сам по себе, до проявления признаков повреждения нейронов. Подробности изложены в статье, опубликованной в журнале Nature Neuroscience.
Считается, что причиной болезни Альцгеймера и лобно-височной деменции становится накоплением гиперфосфорилированных форм ассоциированного с микротрубочками тау-белка. Обнаружение доклинических признаков начинающейся нейроденегерации может помочь замедлить развитие заболеваний. Один из таких признаков – нарушение кровообращения в сосудах головного мозга.
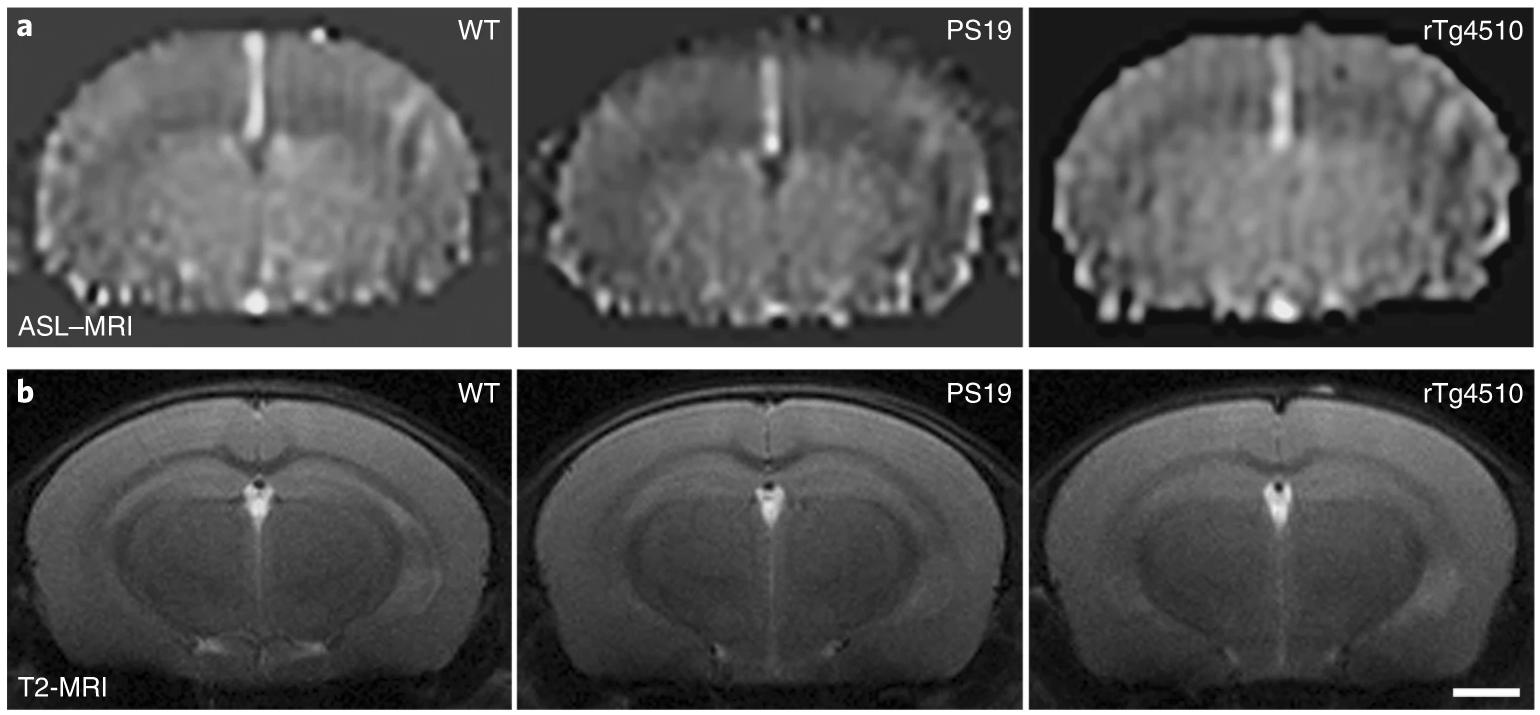
В новом исследовании сообщается, что у мышей, экспрессирующих мутантный тау-белок, подавляется функциональная гиперемия (повышенное кровоснабжение) сосудов мозга, причем это предшествует патологии тау-белка и когнитивным нарушениям. То есть артериолы мозга перестают расширяться при работе участков мозга, в которых начинается накопление токсичных агрегатов.
Нарушения кровотока мозга при болезни Альцгеймера исследуется давно, однако ранее исследователи сосредотачивались на токсичности бета-амилоида, а о прямых эффектах (не опосредованных нейродегенерацией) гиперфосфорилированного тау-белка было известно немного.
Исследователи из США использовали генетически модифицированных мышей, у которых в мозге экспрессировалась мутантная форма тау-белка, подверженная гиперфосфорилированию и образующая агрегаты. Они обнаружили, что накопление такого белка начинает препятствовать функциональной гиперемии еще до гибели нейронов и нарушений поведения. Они также выяснили, что этот эффект происходил из-за снижения синтеза оксида азота (NO) нейронами во время активации глутаматных рецепторов (NMDAR), что в норме приводит к расширению мелких сосудов мозга и увеличению тока крови.
Если говорить более конкретно, то гиперфосфорилированный тау-белок нарушает взаимодействие между белками PSD95 и nNOS (нейрональной синтазой NO), и поэтому активность глутаматных рецепторов перестает быть связана с продукцией нейронами NO.
Авторы статьи утверждают, что нарушение нервно-сосудистого сопряжения из-за тау-белка можно устранить до нейродегенерации, подавив экспрессии этого белка, несмотря на то что уже сформировавшиеся агрегаты сохраняются. Также на основе полученных данных они предполагают, что восстановление NMDAR-зависимой продукции NO может помочь противодействовать некоторым вредным последствиям накопления гиперфосфорилированного тау-белка.
Текст: Настя Горшкова