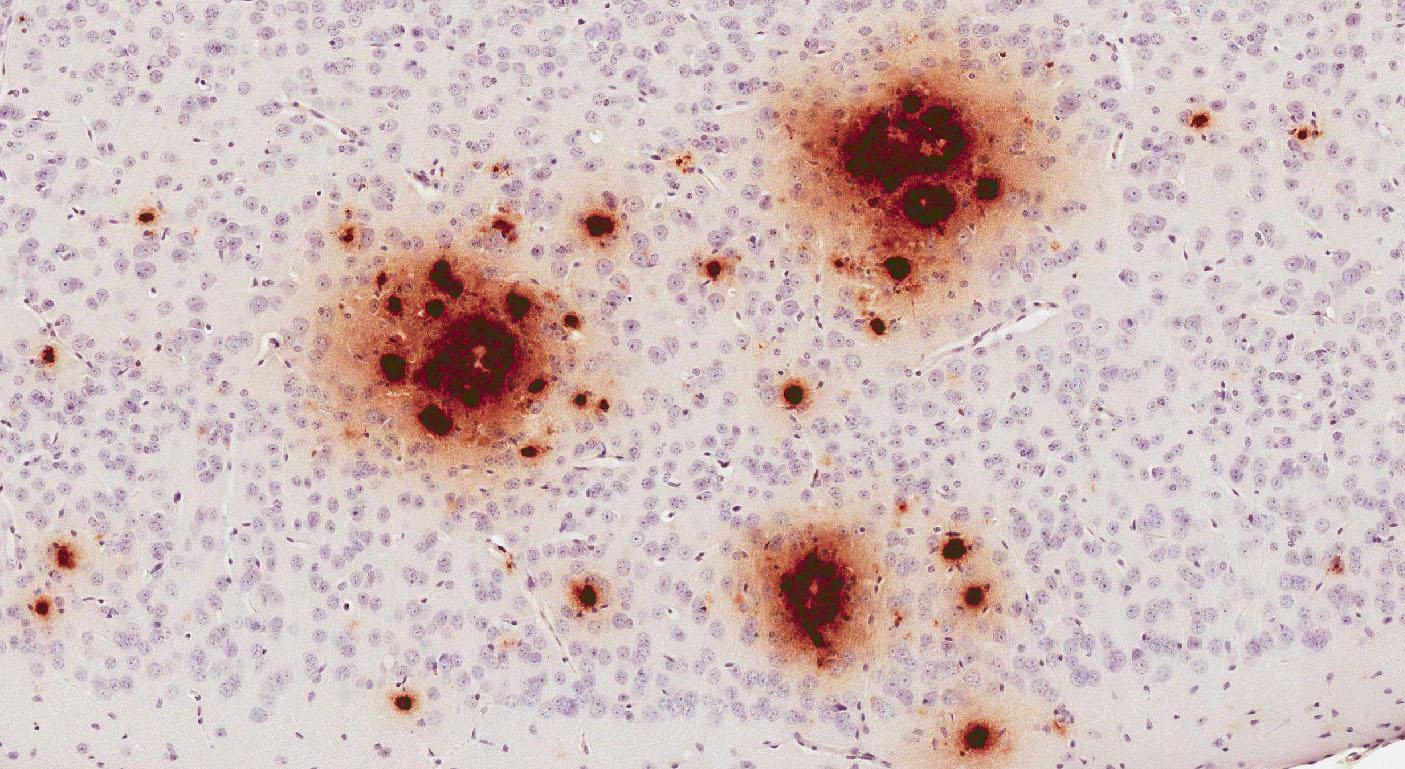
Исследователи экспериментально подтвердили, что введенный извне человеческий бета-амилоид может приводить к болезни Альцгеймера.
Они вводили мышам «загрязненный» бета-амилоидом гормон роста, выделенный из человеческого гипофиза. После этого в мозге животных происходило образование бета-амилоидных бляшек — структур, которые вызывают болезнь Альцгеймера. Статья опубликована в Nature.
Соматотропин, или гормон роста человека (ГРЧ), синтезируется в гипофизе — железе головного мозга. Раньше (до изобретения метода бактериального синтеза ГРЧ) пациентов с его недостатком лечили гормоном, который выделяли из человеческого гипофиза. С 1958 по 1985 год почти 2000 людей получали выделенный ГРЧ, из них у 80 впоследствии развилась болезнь Крейтцфельдта-Якоба — дистрофическое поражение коры головного мозга, вызываемое прионами. Оказалось, что некоторые образцы ГРЧ, которые получали пациенты, содержали прионы.
Три года назад исследователи изучили восемь образцов мозга умерших от прионной болезни пациентов, получавших в детстве ГРЧ. В четырех случаях они обнаружили повреждения серого вещества коры и сосудов отложениями бета-амилоида, которые вызывают церебральную амилоидную ангиопатию (ЦАА) и болезнь Альцгеймера. Тогда было выдвинуто предположение, что бета-амилоид похож на прионы: попадая в организм человека извне, он может приводить к развитию патологий.
В норме в мембране нейронов есть белок — предшественник бета-амилоида. Ученые предполагают, что он регулирует формирование синапсов, нейропластичность и выход железа из клеток. Для разрушения белка два фермента — альфа- и гамма-секретаза — разрезают его на три части. Если вместо альфа- работает бета-секретаза, ферменты иначе режут белок, и в этом случае один из его фрагментов является бета-амилоидом. Он способен образовывать скопления — бета-амилоидные бляшки, которые нарушают работу нейронов и вызывают их гибель, приводя к болезни Альцгеймера. Бляшки также могут откладываться в сосудах, что приводит к ухудшению кровоснабжения мозга, характерному для ЦАА.
Для подтверждения гипотезы о «заразности» бета-амилоида, международная группа ученых под руководством Джона Коллинджа (John Collinge) из Института прионных заболеваний Университетского колледжа Лондона исследовала образцы выделенного ГРЧ из гипофизов, находящиеся в архиве Агентства общественного здравоохранения Англии (Public Health England). При помощи антител к белку они обнаружили в некоторых пробах бета-амилоид.
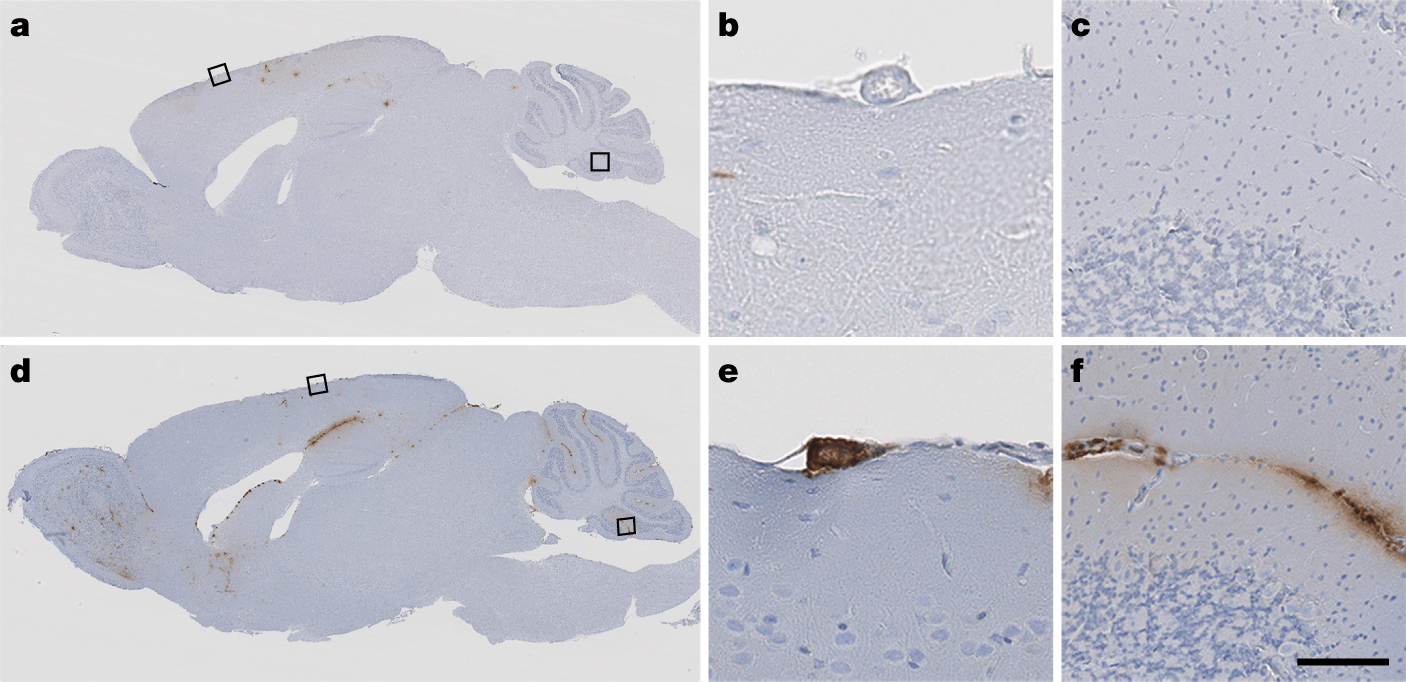
Присутствие белка в образцах, однако, еще не значит, что он может вызывать болезнь Альцгеймера. Исследователи использовали ГМ-мышей, у которых синтезируется человеческий вариант предшественника бета-амилоида и образуются бляшки. Контрольной группе мышей вводили промышленно синтезированный ГРЧ, экспериментальной — образцы выделенного ГРЧ, содержащие бета-амилоид. У экспериментальной группы мышей, в сравнении с контрольной, ученые наблюдали образование бляшек в ткани и сосудах мозга.
Таким образом, ученые экспериментально подтвердили, что введенный извне бета-амилоид потенциально способен вызывать ЦАА и болезнь Альцгеймера. Авторы отмечают, что их результаты не говорят о заразности заболевания. Тем не менее, есть свидетельства «заражения» бета-амилоидом в ходе операций на мозге. Поэтому, отмечают они, стоит обратить внимание на модификацию способов стерилизации хирургических инструментов.
Два года назад мы писали про возможную заразность болезни Альцгеймера. Также у нас можно почитать о диагностике этого заболевания по анализу крови, об увеличении количества бета-амилоида даже после одной бессонной ночи и недавнюю заметку — о связи дневной сонливости с накоплением этого белка в мозге.
Автор: Екатерина Харыбина