Каждый год примерно шесть тысяч человек слышат от врача диагноз «боковой амиотрофический склероз» (БАС). Это значит, что их тела станут в буквальном смысле гробницей, стены которой будут постепенно сжиматься: в конце концов паралич распространится настолько, что человек больше не сможет дышать.
Так умерли Лу Гериг, Мао Цзедун и Стивен Хокинг. За последние сто лет мы прошли путь от полного непонимания того, почему такое происходит, к клиническим испытаниям препаратов: вчера были опубликованы предварительные отчеты о новых успехах — пока, правда, все еще сомнительных — но уже они позволяют ученым говорить о «начале генной терапии БАС». Разбираемся, что именно пытаются «чинить» новые лекарства и объясняет, какой был прок медицине от того, что несколько лет назад весь мир весело опрокидывал на себя ведра с ледяной водой.
«Лечения не существует. Шансы сохранить меня таким, какой я есть, 50 на 50. Возможно, лет через 10 мне понадобится трость», — писал в 1939 году «Железный конь», легенда американского бейсбола, своей жене из клиники Мэйо. Спортсмену было всего 36, а через два года он скончался, потеряв способность не только ходить, но даже подписывать документы без помощи жены. Тогда уже было известно, что дело в прогрессирующей гибели двигательных (моторных) нейронов головного и спинного мозга, но причина ее оставалась неясна. «Дело, наверно, в каком-то микробе, — рассказывал он в том же письме. — Но никто не слышал, чтобы это передавалось между супругами».
Через 35 лет тот же диагноз получил 80-летний диктатор. К тому времени версию о микробах-возбудителях всерьез уже не рассматривали, а нейродегенерацию считали одним из проявлений старения нервной системы. Было понятно, что в ткани мозга появляются какие-то бляшки — как при болезни Альцгеймера или Паркинсона — которые и вызывают прогрессирующий паралич. Именно эти бляшки, тогда еще неясной природы, за десять лет превратили бодрого старика, который и в 72 года переплывал Янцзы, — в безнадежного пациента, который мог дышать, только лежа на боку. От диагноза до смерти, как и в случае с бейсболистом, прошло около двух лет.
Британскому астрофизику повезло больше. Свой приговор он услышал еще до того, как его собрат по несчастью пересек Янцзы в последний раз, но болезнь остановилась в полушаге от летального финиша. Медленно теряя подвижность головы, ученый прожил еще 55 лет, стал иконой научпопа и новым символом своей болезни. За это время стало понятно, что агрегаты в мозге состоят из белков, у этих белков появились имена, а на горизонте замаячили возможные гены-виновники. Полсотни клинических испытаний лекарств стартовали и сошли с дистанции досрочно. Миллионы людей вылили на себя ведра ледяной воды, собирая деньги на исследование болезни. Но никто так и не понял, как ее лечить.
Боковой амиотрофический склероз (БАС), который погубил Лу Герига, Мао Цзэдуна и Стивена Хокинга — лишь одно из множества нейродегенеративных заболеваний, против которых человечество до сих пор бессильно. И хотя далеко не всегда БАС заканчивается деменцией, с болезнями Альцгеймера и Паркинсона его сравнивали не зря. Препятствия, которые отделяют нас от лекарства, во всех этих случаях примерно одни и те же: предсказать болезнь невозможно, диагностировать на ранних стадиях удается не всегда, причины многоообразны, а список их не полон.Вдобавок к этому, повреждения быстро становятся необратимыми, поскольку нейроны, в отличие от множества других клеток, не так просто заменить на новые.
Как и в случае с болезнями Альцгеймера и Паркинсона, единственные лекарства, которые существуют от бокового амиотрофического склероза, помогают лишь компенсировать симптомы. В случае БАС, они блокируют либо избыточное выделение глутамата, ненадолго отдаляя гибель нейронов, либо подавляют окислительный стресс — но как это работает, не знают даже в FDA (американском Минздраве), где одобрили соответствующий препарат. Остановить нейродегенерацию не удалось пока никому.
И вот в последнем номере журнала The New England Journal of Medicine появились результаты двух новых клинических испытаний и обзор, который отмечает начало новой эры в схватке с непокорной болезнью. По мнению авторов обзора, мы наконец-то смогли прицелиться в самый корень амиотрофического склероза. А, значит, забрезжила надежда на успех. Тем удивительнее, что и мишень, и оружие для ее поражения давно известны: первая была открыта более 25 лет назад, второе — известно больше полувека. Но встретиться они смогли только сейчас.
Изобрести оружие
Передача информации в клетке строится по принципу липучки. Двунитевая липучка-ДНК разделяется на две половины, а копирующие ферменты достраивают к одной из половин парную (комплементарную) липучку-РНК. Получается РНК-копия гена, которая отправляется из ядра в цитоплазму для синтеза белка. К информационной РНК-липучке по очереди подплывают транспортные РНК, несущие аминокислоты. Прилипание в правильной последовательности позволяет построить из аминокислот белковую цепь.
«Заблокировать» ген или остановить его экспрессию можно множеством разных способов, но проще всего — комплементарно заклеить, чтобы никто другой к нему уже не прилип. Так умеют делать даже бактерии, и этот способ регулировать экспрессию у них обнаружили еще в 1967 году, спустя всего несколько лет после открытия информационной РНК. Тогда оказалось, что в клетках кишечной палочки производится некодирующая РНК, которая прилипает к определенным участкам информационной РНК и мешает им передавать информацию дальше.

Через 10 лет так научились поступать и люди, уже в своих целях. Гарвардские ученые создали короткую цепочку (олигонуклеотид) ДНК, которая была комплементарна участку вируса саркомы Рауса. Прилипая к вирусной РНК, олигонуклеотид мешал вирусу размножаться, а клеткам, зараженным вирусом, — превращаться в опухолевые. Так появилась технология антисмысловых олигонуклеотидов — коротких цепочек, которые комплементарны «осмысленным» частям гена и благодаря этому могут и останавливать его работу.
С тех пор наше представление о «липучках» и «антилипучках» сильно усложнилось. Среди некодирующих РНК выделили множество разных типов — они отличаются по длине, происхождению и функциям. Оказалось, что действовать они могут на самых разных уровнях: блокировать создание РНК, ее созревание и последующий синтез белка, или просто заставлять клеточные ферменты разрезать ее на куски. И все это можно было использовать для антисенс-терапии — научиться строить комплементарные ДНК- или РНК-нити к нужному гену, чтобы управлять его работой.
Дело оставалось за малым — найти, куда стрелять.
Найти мишень
Первое лекарство, в состав которого вошли антисмысловые олигонуклеотиды, появилось в 1998 году. Оно эксплуатировало ту самую идею, с которой началась история антисенс-терапии — заблокировать размножение вируса. Лекарство охотилось на цитомегаловирус, который здоровым людям обычно не страшен, а вот по организму больных СПИДом распространяется бесконтрольно.
Однако довольно быстро оказалось, что проще предотвратить сам СПИД, чем бороться с его последствиями — и в 2006 году цитамегаловирусное лекарство исчезло с рынка, уступив место антиретровирусным препаратам. Испытания олигонуклеотидов против других вирусов начались, но успехом до сих пор не увенчались. И наступило затишье.
По вирусу стрелять относительно несложно — достаточно прочесть его, как правило, небольшой геном, и подобрать нужный участок гена. С человеком в этом смысле гораздо сложнее. Среди двадцати тысяч его генов непросто прицелиться в нужный, особенно если не знать достоверно, какой из них доставляет проблемы — а именно так обстоит дело с большинством нейродегенеративных болезней.
К тому моменту, когда появилось антисенс-лекарство против цитомегаловируса, геном человека еще даже не был прочтен целиком. А до первого полногеномного поиска ассоциаций (GWAS-исследования), с помощью которого сегодня ищут генетические причины чего угодно (от болезней до их предположительной связи с поведением), оставалось еще четыре года.
Технология антисмысловой терапии опередила свое время. Оружие появилось раньше, чем нашлась мишень — цитомегаловирус в этом смысле был просто разминкой.
С боковым амиотрофическим склерозом в этом смысле нам повезло чуть больше, чем с другими болезнями — о нем мы что-то знали еще до первых полногеномных поисков. Несмотря на то, что далеко не всегда он передается по наследству (а значит, не все его случаи можно соотнести с конкретной мутацией), примерно каждый пятый случай связан с мутацией в гене SOD1. Он кодирует белок супероксиддисмутазу, один из главных клеточных антиоксидантов. Однако участие SOD1 в развитии БАС никак не связано с его основными функциями: судя по всему, белок-мутант ведет себя как прион — в двигательных нейронах спинного мозга он образует белковые агрегаты, которые растут, подобно снежному кому. Они нарушают внутриклеточный транспорт в двигательных нейронах, постепенно приводя к их гибели.
Обвинение в адрес SOD1 ученые выдвинули еще в 1993 году. Дело за малым: осталось только прочесть ген, собрать антисмысловую нить и заблокировать его работу. Но в процессе возникли новые трудности. Например, выяснилось, что мутаций в SOD1 существует не менее двух сотен, и не все они в равной степени связаны с развитием БАС. Кроме того, антисмысловые РНК оказались довольно нестабильными: в клетке их быстро расщепляют РНКазы, а в крови иммунные клетки принимают их за вирусы — и все заканчивается воспалением и разрушением лекарства.
Чтобы подобрать нужную антисмысловую цепочку, сделать ее устойчивой и отработать на мышах, понадобилось еще двадцать лет. За это время в области антисенс-терапии появились обнадеживающие примеры — препараты против спинальной мышечной атрофии и некоторых форм миодистрофии Дюшенна. Теперь выходить на клинические испытания с антисмысловой РНК гораздо проще — мы знаем наверняка, что такое лечение может сработать.
Предупредительный выстрел
Две исследовательские группы, которые опубликовали свои результаты в NEJM, сделали одно и то же, но разными способами. Первая группа, из Массачусетса, пошла по пути генной терапии, то есть поместила нить РНК внутрь аденовируса, чтобы «заразить» ей мотонейроны. В испытании приняли участие только двое пациентов — первый шаг на пути к более серьезным проверкам — с подтвержденными мутациями в гене SOD1.
Один из них получил экспериментальную терапию спустя несколько месяцев после постановки диагноза. Лечение не вызвало значимого клинического улучшения, и через 15 месяцев он скончался. Однако на вскрытии исследователи обнаружили, что в его спинном мозге количество мутантного SOD1 на 90 процентов ниже, чем в среднем у пациентов с БАС. Это может означать, что терапия работает, хотя и не спасает на той стадии нейродегенерации, на которой испытуемый был на момент начала лечения. Второй пациент после терапии стабилизировался и до сих пор жив, поэтому количество SOD1 в его спинном мозге остается неизвестным.
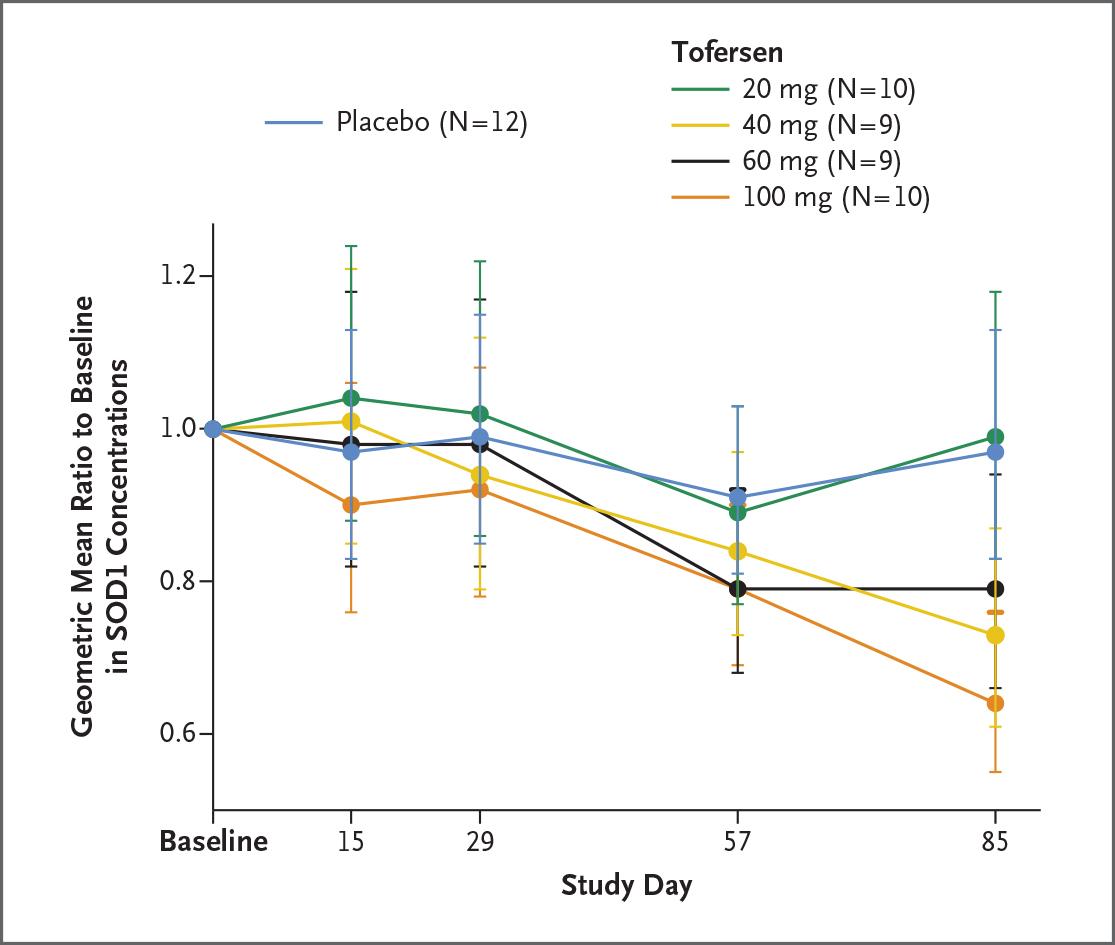
Другая исследовательская группа представляет крупную фармацевтическую компанию Biogen, которая, среди прочего, производит антисенс-олигонуклеотиды против спинальной мышечной атрофии. Это не первое их исследование антисенс-терапии БАС, результаты отражают 1-2 фазу испытания, а результаты 3 фазы они ожидают через год.
В этом испытании приняли участие 50 пациентов с мутациями в SOD1: четыре группы получали разные дозы препарата, пятая служила контролем. В первую очередь ученых интересовала безопасность: оказалось, что многие побочные эффекты связаны с уколом в спинной мозг и не зависят от того, вводили в него плацебо или олигонуклеотид. Кроме того, они измеряли концентрацию SOD1 в спинномозговой жидкости (она служит косвенным маркером того, насколько активно белок образуется в нейронах) — самые высокие дозы препарата снизили ее в среднем на 32 процента. При этом когда исследователи постфактум разделили пациентов на группы с быстрым и медленным развитием болезни, то оказалось, что для первых лечение могло оказаться эффективнее: внешние признаки дегенерации у них стали возникать медленнее, а в спинномозговой жидкости стало меньше маркеров гибели нейронов.
Что принесли в ведре воды
Авторы обеих статей стараются избегать громких утверждений и прогнозов — особенно учитывая, что до конца вылечить никого не удалось, и даже цели такой не стояло (как это обычно бывает в первых фазах исследований). Но давайте на минуту представим себе, что третья фаза пройдет успешно и разрушение нейронов у пациентов удастся если не обратить, то хотя бы остановить. Будет ли это означать, что боковой амиотрофический склероз повержен, и на очереди Паркинсон и Альцгеймер?
На примере даже этих скромных испытаний видно, насколько прицельно бьет олигонуклеотидное ружье. Даже в том случае, когда пациенты специально отобраны так, что несут мутацию в одном и том же гене, группа все равно распадается на две с разным эффектом от лечения. Но мутации в SOD1 — это не более 20 процентов случаев наследственного БАС.
В 2014 году фейсбук заполнили миллионы роликов с людьми, выливающими на себя ледяную воду. Флешмоб Ice Bucket Challenge за пару месяцев собрал более 200 миллионов долларов на исследования бокового амиотрофического склероза, поддержку пациентов и поиск лекарств. На эти деньги, среди прочего, удалось провести GWAS и пополнить список мишеней тремя новыми мутациями, и теперь он «закрывает» почти все случаи наследственного БАС. Для каждой из мутаций понадобится свой антисмысловой олигонуклеотид, и, возможно, не один.
С точки зрения «одна мутация — одна таблетка» можно сказать, что мы имеем дело не с одной болезнью, а со множеством. Теперь мы не можем даже быть уверенными, что три самых известных жертвы БАС болели одним и тем же. Судя по тому, что у Лу Герига болезнь проявилась рано, у Мао Цзедуна — поздно, а у Стивена Хокинга приостановилась на десятки лет, они могли нести в своих генах разные мутации. Но тогда никому не приходило в голову это проверить, и теперь мы не узнаем, могли бы мы сейчас кого-то из них спасти.
Эта же проблема встанет перед нами и в случае других нейродегенеративных патологий. Ни у болезни Альцгеймера, ни у болезни Паркинсона, ни у множества других менее известных синдромов до сих пор не найден единый ген-виновник. Списки множатся, ставки растут. И несмотря на то, что мы знаем наверняка, что антисмысловая терапия работает, а индивидуальные лекарства возможны, страшно представить, сколько ведер ледяной воды придется на себя вылить, прежде чем мы найдем таблетку для каждого.
Автор: Полина Лосева
