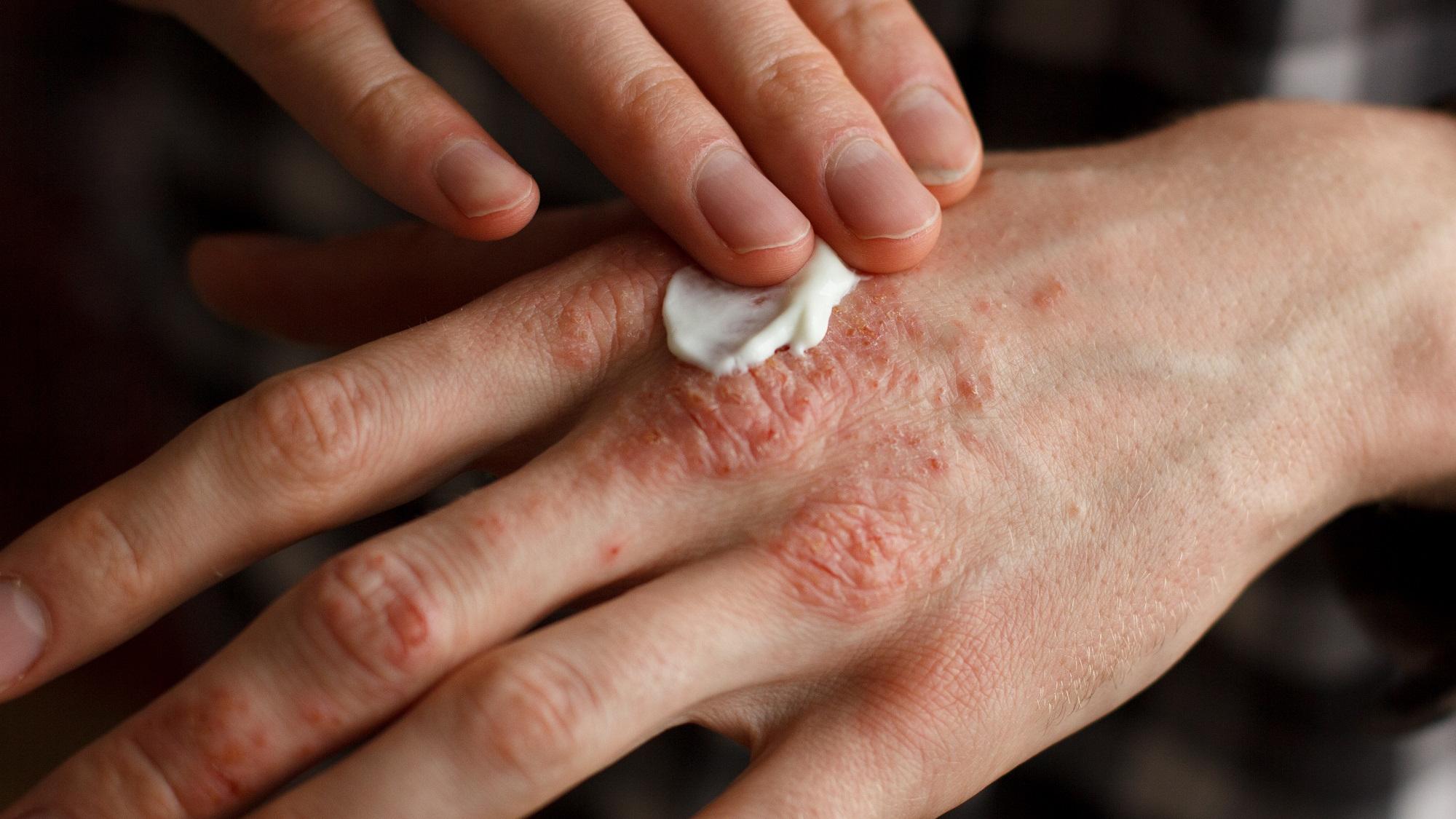
Учёные с помощью симуляций и на модельных животных доказали эффективность нового средства от псориаза. Препарат может применяться в виде мази и при этом сохраняет эффективность в течение долгого времени.
Псориаз, хроническое заболевание кожи, вызывающее зуд, покраснение и шелушение, в год поражает более 125 миллионов человек во всем мире. Для лечения заболевания используются мази с содержанием стероидов, но иногда они вызывают раздражение и истончение кожи, а их эффективность со временем снижается. Существуют и антитела, которые нейтраилизуют специфические воспалительные молекулы, вырабатываемые при псориазе, но, поскольку они не впитываются в кожу, а вводятся в виде инъекций, их применение ограничено и иногда имеет системные побочные эффекты.
Команда исследователей из Гарвардского института Биоинженерии имени Вайсса (Harvard’s Wyss Institute for Biologically Inspired Engineering) и Школы инженерных и прикладных наук Джона А. Полсона (John A. Paulson School of Engineering and Applied Sciences) обошли эти ограничения, применив ионную жидкость (ИЖ) на основе малых интерферирующих РНК (siRNA) непосредственно на коже для успешного лечения псориаза у мышей. Это позволило значительно снизить уровень воспалительных цитокинов и симптомов псориаза без системных побочных эффектов. Недавно исследование было опубликовано в журнале Science Advances.
Испытание препарата при помощи симуляции
Синтетические siRNA — это некодирующие двухцепочечные молекулы РНК, которые обычно используются, чтобы «заглушить» нужный ген путём уничтожения его транскриптов РНК. Эта способность делает их очень привлекательными для лечения заболеваний без изменения ДНК в клетках пациента. Однако их использование в медицине затруднено, так как РНК — это большие гидрофильные молекулы и им трудно пересекать гидрофобные мембраны клеток.
Команда из Института Вайсса и SEAS справилась с этой задачей, использовав недавно открытый класс материалов под названием ионные жидкости. По сути, это соли, которые превращаются в жидкость при комнатной температуре. Основываясь на более ранних исследованиях по изучению взаимодействия ИЖ с липидами, исследователи догадывались, что они могут стабилизировать siRNA и улучшить их проникновение через клеточные мембраны на основе липидов, обеспечивая локализованное глушение генов.
Команда создала каталог различных ИЖ и протестировала их комбинации, чтобы посмотреть, какие из них имеют нужные физические и химические свойства. Они остановились на смеси двух — CAGE (холин и гераниевая кислота) и CAPA (холин и фенилпропановая кислота), что помогло ассоциированным молекулам siRNA, сохраняя структурную целостность, лучше проникать в свиную кожу во время экспериментов in vitro. На коже живых мышей смесь CAGE+CAPA тоже не вызывала воспаления или раздражения — благодаря своей нетоксичности.
Поскольку ИЖ — это новый материал, точно предсказать её действие довольно сложно. В сотрудничестве с соавтором Чарльзом Рейли (Charles Reilly), Ph.D., старшим научным сотрудником платформы Bioinspired Therapeutics & Diagnostics в Институте Вайсса, исследователи смоделировали молекулярную динамику, чтобы понять, как раствор CAGE+CAPA будет взаимодействовать с siRNA и клеточными мембранами на молекулярном уровне. Наблюдения, полученные в ходе симуляций, показали, что этот комплекс обладает превосходной стабильностью благодаря сильным химическим взаимодействиям его ионов с парами оснований РНК, и что это соединение облегчает проникновение в клеточные мембраны. Благодаря тому, что ионы в ИЖ могут расположиться достаточно близко друг к другу, способность раствора пройти сквозь мембрану сильно увеличилась.
Разрушая преграды
Вооружившись проникающими способностями раствора, команда соединила его с особой siRNA, предназначенной для глушения гена под названием NFKBIZ, который был вовлечён в регуляцию ряда провоспалительных молекул, связанных с псориазом. Исследователи наносили смесь CAGE+CAPA вместе с siRNA на кожу мышей, больных псориазом, в течение четырёх дней и затем сравнивали этих мышей с теми, которые получали другие виды лечения (CAGE+CAPA с контрольной siRNA, просто CAGE+CAPA) и с контрольной группой.
У мышей, которых лечили NFKBIZ siRNA, по сравнению с другими экспериментальными группами снизились такие побочные эффекты, как утолщение эпидермиса, обесцвечивание кожи и разрастание кератина, а также покраснение и шелушение. К тому же, обнаружилось значительное снижение экспрессии NFKBIZ и других связанных с псориазом генов в клетках кожи. То есть, впервые было продемонстрировано, что комплексы ИЖ-siRNA при местном применении могут достигать терапевтического эффекта как на молекулярном, так и на макроскопическом уровне путём глушения нужного гена in vivo.
Это средство на основе ИЖ может быть легко трансформировано для взаимодействия с различными терапевтическими молекулами, включая ДНК и антитела. Оно также может расширить возможности трансдермального переноса лекарств для лечения других дерматологических заболеваний кожи, включая экзему, и улучшить долгосрочные эффекты терапии путём целенаправленного воздействия на гены, которые задействованы в заболевании.
Основываясь на обнадёживающих результатах этих испытаний, лаборатория одного из исследователей, Самира Митраготри (Samir Mitragotri), Ph.D., будет сотрудничать с учёными различных направлений, уделяя особое внимание изучению локальных и системных механизмов, связанных с аутоиммунными и воспалительными заболеваниями кожи.
«Многие инновации, которые биологи использовали в исследованиях в течение долгих лет, имеют значительный клинический потенциал, но большинство из них не достигли его из-за фундаментальных ограничивающих факторов, таких как, в данном случае, создаваемый кожей барьер. Это творческое решение проблемы доставки лекарственных средств в кожу открывает широкие перспективы для создания давно ожидаемого нового класса эффективных методов лечения», — прокомментировал директор-основатель Института Вайсса и соавтор статьи Дональд Ингбер, доктор медицины, Ph.D., профессор сосудистой биологии в Гарвардской медицинской школе (Harvard Medical School) и Бостонской детской больнице (Boston Children’s Hospital), а также профессор биоинженерии в SEAS.
Подготовка материала: Мария Толмачёва