В США начались клинические испытания CRISPR-терапии для борьбы с одной из формы врожденной слепоты — амаврозом Лебера 10 типа. Первому пациенту ввели раствор под сетчатку одного из глаз, оценить успехи терапии можно будет только через месяц.
Сейчас же ученые просто сообщают, что это первый случай, когда технологию CRISPR/Cas9 применяют для редактирования генома человека in vivo. Подробнее об испытаниях можно прочесть в пресс-релизе компании Editas Medicine или в репортаже Associated Press.
Разговоры о генетическом редактировании с помощью CRISPR/Cas9 идут уже несколько лет, но клинические успехи (если не считать генетически модифицированных детей в Китае) появились только недавно — например, первых пациенток удалось избавить от серповидноклеточной анемии и бета-талассемии. Тем не менее, во всех этих случаях редактирование происходило in vitro: у людей забирали часть клеток, например, стволовые клетки крови, обрабатывали системой CRISPR/Cas9, размножали и вводили обратно в организм.
До сих пор никому не удавалось успешно отредактировать геном человека in vivo. В 2018 году ученые пробовали применить предыдущую технологию редактирования — нуклеазу «цинковые пальцы» — на больном с синдромом Хантера, но результаты оказались неоднозначными. Теперь же компании Editas Medicine и Allergan предприняли новую попытку.
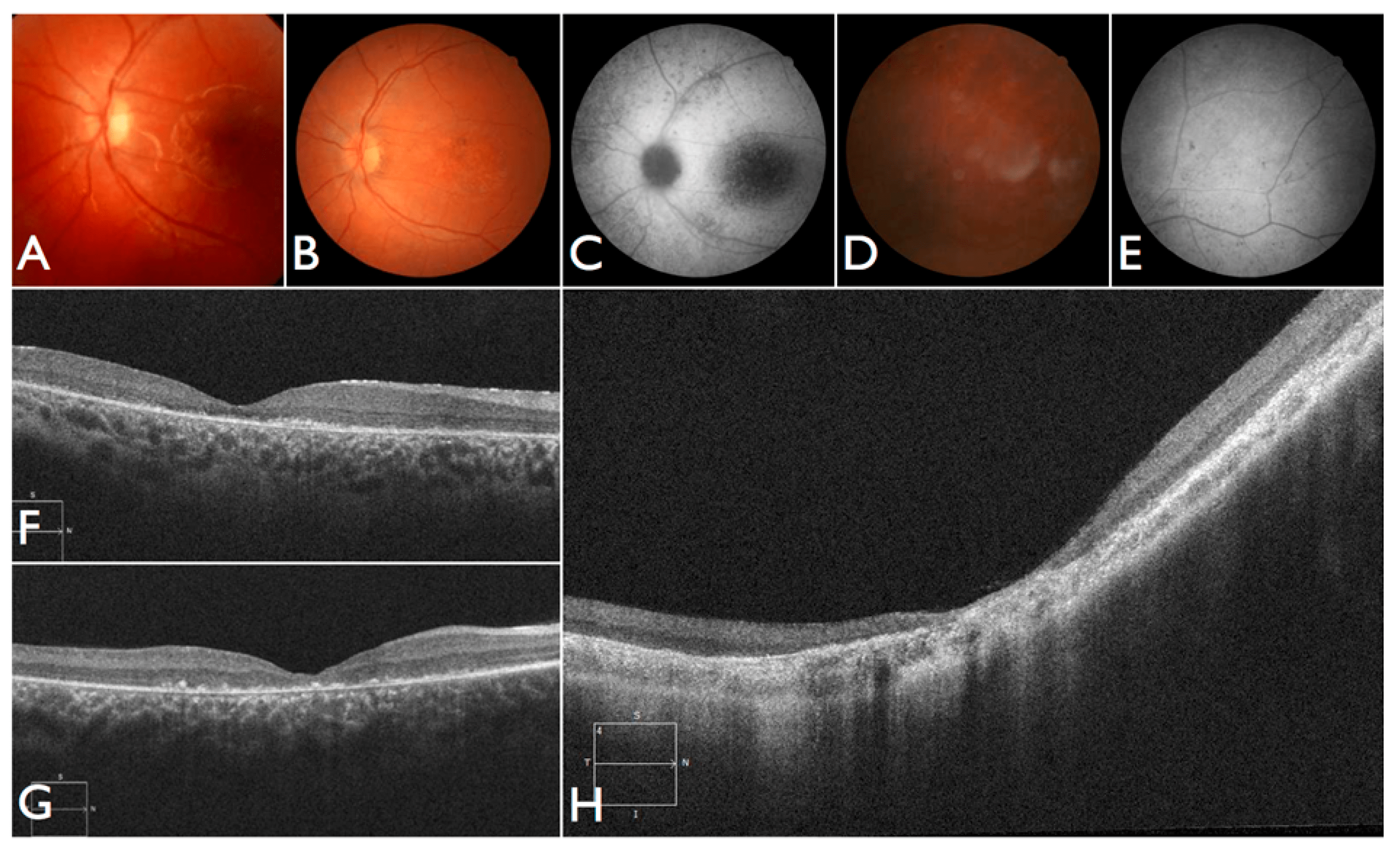
В качестве мишени они выбрали одну из форм врожденной слепоты — конгенитальный амавроз Лебера 10 типа. При этой болезни человек или рождается слепым, или теряет зрение вскоре после появления на свет, но сам глаз при этом выглядит здоровым. Причина слепоты — мутация в гене CEP290, который отвечает за формирование выростов в фоторецепторных клетках — палочках и колбочках. У носителей этой мутации структура сетчатки соответствует норме, но клетки развиваются неполноценно и неспособны воспринимать свет. С течением времени такие клетки гибнут, поэтому важно начать лечение достаточно рано, пока их еще можно спасти.
Слепота — очень удобная модель для тестирования новых технологий. Во-первых, у таких пациентов легко отследить результат лечения. Во-вторых, у них снижен риск отторжения препарата, поскольку глаз — это иммунопривилегированная зона, туда не добирается большинство клеток иммунитета. В-третьих, из-за того, что глаз изолирован от общего кровотока, крайне маловероятно, что препарат мигрирует куда-то за его пределы. Это важно как для лечения стволовыми клетками (чтобы избежать метастазирования при перерождении в опухоль), так и для генетического редактирования (чтобы исправления не затронули другие ткани и органы).
Кроме того, уже известно, что слепота поддается лечению с помощью генной терапии. В 2017 году в США одобрили препарат Luxturna: он доставляет в клетки здоровую копию гена и позволяет смягчить симптомы амавроза Лебера 2 типа (он вызван другой мутацией). The Washington Post рассказывала историю человека, которому Luxturna частично вернула зрение: он начал ориентироваться в темноте, впервые в жизни увидел звезды и научился различать эмоции на лице своей матери.
Но не каждый ген можно доставить в клетки извне. Амавроз Лебера 10 типа вызван мутацией в более длинном гене, слишком крупном для вирусных частиц, которые используют для генной терапии. Поэтому препарат Editas Medicine и Allergan — это полноценное генетическое редактирование in vivo. Пациенту под общим наркозом ввели тонкую иглу под сетчатку одного из глаз и доставили молекулы системы CRISPR/Cas9 прямо к палочкам и колбочкам. Сама по себе операция не несет в себе рисков для здоровья, но насколько она эффективна, можно будет оценить по меньшей мере через месяц.
Специалисты компании планируют попробовать новую терапию на 18 пациентах с разной степенью потери зрения. Их разделят на три группы, каждая из которых получит свою дозу. Если лечение окажется успешным, у пациентов будет возможность повторить операцию на своем втором глазу.
Автор: Полина Лосева