Пятеро больных поросят c миодистрофией Дюшенна получили инъекцию молекулярной системы CRISPR/Cas9 и в результате прожили на треть дольше, чем обычно живут свиньи с миодистрофией. Кроме того, им удавалось дольше держаться на ногах, а их сердце работало без перебоев.
Ученые также проверили свою методику на предшественниках мышечных клеток человека и убедились в том, что у этого подхода есть шанс попасть в клиническую практику. Работа опубликована в журнале Nature Medicine.
Миодистрофия Дюшенна — это генетическое заболевание, которым страдают в основном мальчики, поскольку соответствующий ген расположен на Х-хромосоме, а Y-хромосома не может компенсировать его дефект. У пациентов с болезнью Дюшенна производится аномальная версия белка дистрофина. В норме он прикрепляет мышечные клетки к волокнам внеклеточного вещества и отвечает за то, чтобы усилие от сокращения мышечных клеток передавалось на окружающие ткани. Мутантный белок с этой функцией справляется плохо, мышцы постепенно начинают работать «вхолостую», без видимого эффекта, и постепенно разрушаются. Как только дегенерация доходит до диафрагмы и сердечной мышцы, пациент погибает, поскольку лекарства от миодистрофии пока не существует.
Как и для других генетических заболеваний, для болезни Дюшенна ученые разрабатывают генную терапию, которая позволила бы исправлять ген прямо в клетках живого пациента. Для этого обычно используют систему «молекулярных ножниц» CRIPSR/Cas9, которую с помощью вирусных векторов вводят в кровь модельных животных. Этот метод отработали уже на мышах и собаках-биглях, теперь очередь дошла и до более близкого к человеку модельного объекта — свиньи.
Группа ученых под руководством Кристиана Купатта (Christian Kupatt) из Мюнхенского центра исследований сердечно-сосудистой системы воспроизвела миодистрофию Дюшенна на свиньях. Исследователи внесли в геном животных мутацию, которая полностью нарушила производство дистрофина. 61,6 процентов таких животных умирали в первую неделю после появления на свет, а остальные жили дольше 105 дней. Причиной смерти, как правило, у них становилась аритмия.
В качестве терапии ученые подобрали гидовую РНК, которая направляет CRISPR/Cas9 на мутантную часть генома свиней. Затем CRIPSR/Cas9 вырезает этот участок, и клетки снова начинают производить дистрофин — укороченную, но функциональную его версию.
Для начала исследователи ввели гидовую РНК и CRISPR/Cas9 в переднюю и заднюю ноги 10-дневных поросят с одной стороны (вторая служила в качестве контроля). Через две недели они обнаружили, что в «экспериментальных» конечностях мышечные клетки начали производить дистрофин. В «контрольных» конечностях они тоже заметили экспрессию белка, но крайне слабую — судя по всему, это был просто результат «утечки» препарата вместе с кровью из «экспериментальных» ног. В ключевых для миодистрофии мышцах — сердечной и диафрагме — дистрофина не обнаружили.
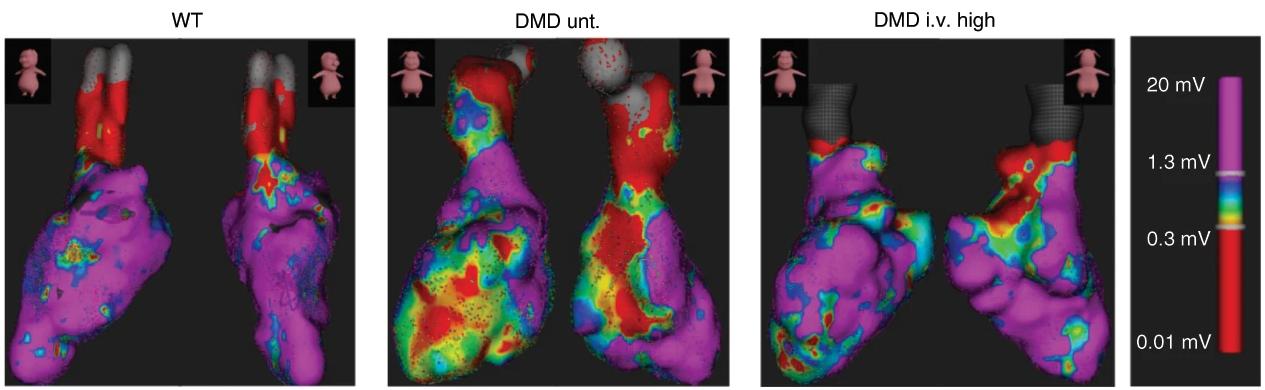
Таким образом ученые продемонстрировали, что их препарат может работать в мышечной ткани. Чтобы распространить его действие на весь организм, они начали вводить его внутривенно. После этого дистрофин удалось обнаружить также в сердце и диафрагме, а животные стали более выносливыми физически. В то время как обычная свинья может провести на ногах около 400 минут, а больная дистрофией — немного более 200, то после генной терапии больные животные практически достигли контрольных значений.
Кроме того, у экспериментальных животных нормализовался сердечный ритм: и частота, и амплитуда, и мембранный потенциал клеток сердечной мышцы стали близки к контрольным. Наконец, после терапии свиньям удалось дожить до 136 дней, что примерно на треть больше срока, на который могут рассчитывать животные с дистрофией.
Ученые проверили, что их терапия не только эффективна, но и не вносит лишних повреждений в геном: по крайней мере, в пяти местах, где они ожидали найти следы нецелевого редактирования, их обнаружить не удалось. Поэтому они попробовали применить ее и на клетках человека. В качестве модельного объекта исследователи взяли индуцированные плюрипотентные клетки (то есть клетки взрослого человека, репрограммированные до зародышевого состояния) — от больного миодистрофией и от здорового добровольца. Они обнаружили, что, в отличие от здоровых, мутантные клетки плохо дифференцируются в предшественники мышц. Но после обработки CRIPSR/Cas9 они становятся практически неотличимы от контроля (p < 0,0001) — ни по количеству образованных клеток-предшественников, ни по амплитуде сокращений. Следов нецелевого редактирования в них тоже не обнаружилось.
От редактора
Поскольку генная терапия для миодистрофии Дюшенна уже показала свою эффективность у трех разных видов животных, можно ожидать, что рано или поздно ее попробуют применить и на людях. Правда, полного исцеления добиться пока не удалось, и носители мутации все равно живут меньше, чем здоровые животные. Возможно, это означает, что главным камнем преткновения окажется не безопасность или эффективность самого генетического редактирования, а эффективность доставки «молекулярных ножниц» в ткани и равномерность их работы в клеточных пластах.
Автор: Полина Лосева
