Исследователи отредактировали клетки сердечной мышцы с мутациями, приводящими к развитию миодистрофии Дюшенна. При помощи системы CRISPR-Cas9 мутантные участки гена «выбросили» из мРНК, а из клеток с «исправленной» ДНК вырастили бьющуюся сердечную мышцу.
Ген DMD является самым большим в геноме человека и кодирует белок дистрофин — структурный белок, обеспечивающий связь мышечных волокон с окружающим матриксом. Нарушение синтеза дистрофина из-за стоп-мутаций в гене приводит к развитию прогрессирующей с возрастом мышечной дистрофии — заболевания, известного как миодистрофия Дюшенна. Помимо того, что больные со временем утрачивают способность ходить, у них также развивается кардиомиопатия — деградация сердечной мышцы, которая в итоге приводит к смерти человека в возрасте 20-30 лет.
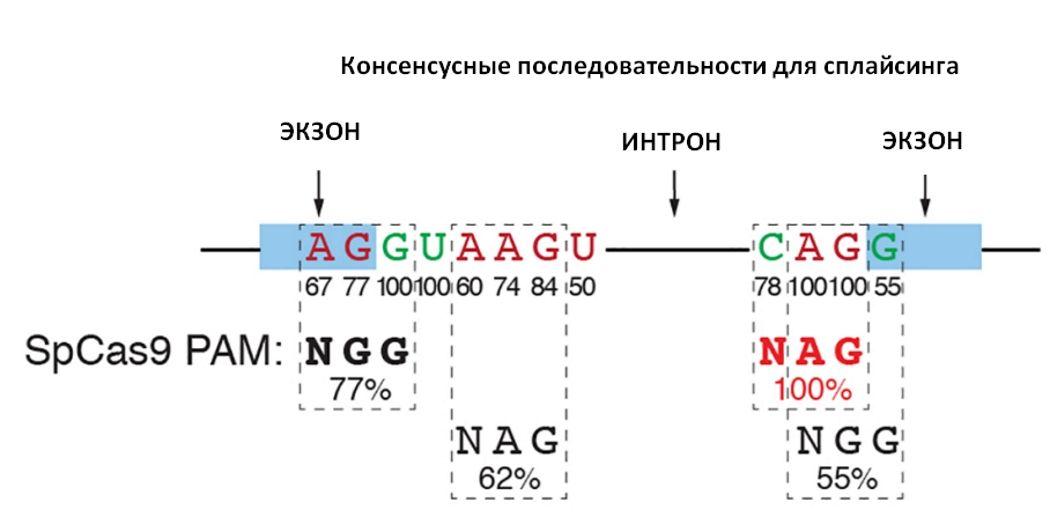
Ген дистрофина имеет сложную структуру и содержит множество некодирующих участков, которые разделяют «значимые» области гена — экзоны. В процессе сплайсинга мРНК некодирующие участки вырезаются, а экзоны «склеиваются» друг с другом. Ген и его продукт очень большие (ген содержит 79 экзонов), и исследователи обнаружили, что удаление одного или нескольких экзонов приводит к образованию укороченного, но все еще функционального белка. Таким образом, экзон, в который попала стоп-мутация, можно выбросить, и это частично восстановит работу мышц. Такой подход к терапии миодистрофии, который называется «пропуск экзонов» (exon skipping), один из самых перспективных на сегодняшний день и проходит клинические испытания на пациентах, а один из препаратов был одобрен FDA.
Исследователи из Юго-Западного медицинского центра Университета Техаса (США) использовали для реализации «пропуска экзонов» систему CRISPR-Cas9. Удобство применения этой системы в данном случае определяется тем, что последовательности, указывающие белкам сплайсинга, где надо разрезать мРНК, содержат в себе PAM-мотивы для Cas9, определяющие мишени нуклеазы. Разрез в этой последовательности для конкретного экзона и последующая репарация по механизму негомологичного соединения концов, по которому по умолчанию «залечиваются» двухцепочечные разрывы в ДНК, приведет к тому, что экзон не будет узнаваться белками сплайсинга и не будет включаться в зрелую мРНК.
Известно около трех тысяч мутаций в гене DMD, определяющих развитие миодистрофии Дюшенна, которые группируются в «горячих точках» мутагенеза, сосредоточенных преимущественно в 12 экзонах. Ученые подобрали направляющие РНК для внесения разрезов при помощи Cas9 во всех 12 экзонах, и, таким образом, создали универсальный набор для «пропуска экзонов», подходящий для большинства пациентов. CRISPR уже использовали для редактирования гена дистрофина, но мишенью в предварительных испытаниях был только один экзон.
Так как у модельных мышей с миодистрофией кардиомиопатия не развивается, технологию проверили на человеческих кардиомиоцитах (клетках сердечной мышцы), которые были получены из стволовых клеток с различными нарушенными функциями дистрофина. Оказалось, что «пропуск экзонов» при помощи CRISPR-Cas эффективно восстанавливает экспрессию дистрофина в культуре клеток.
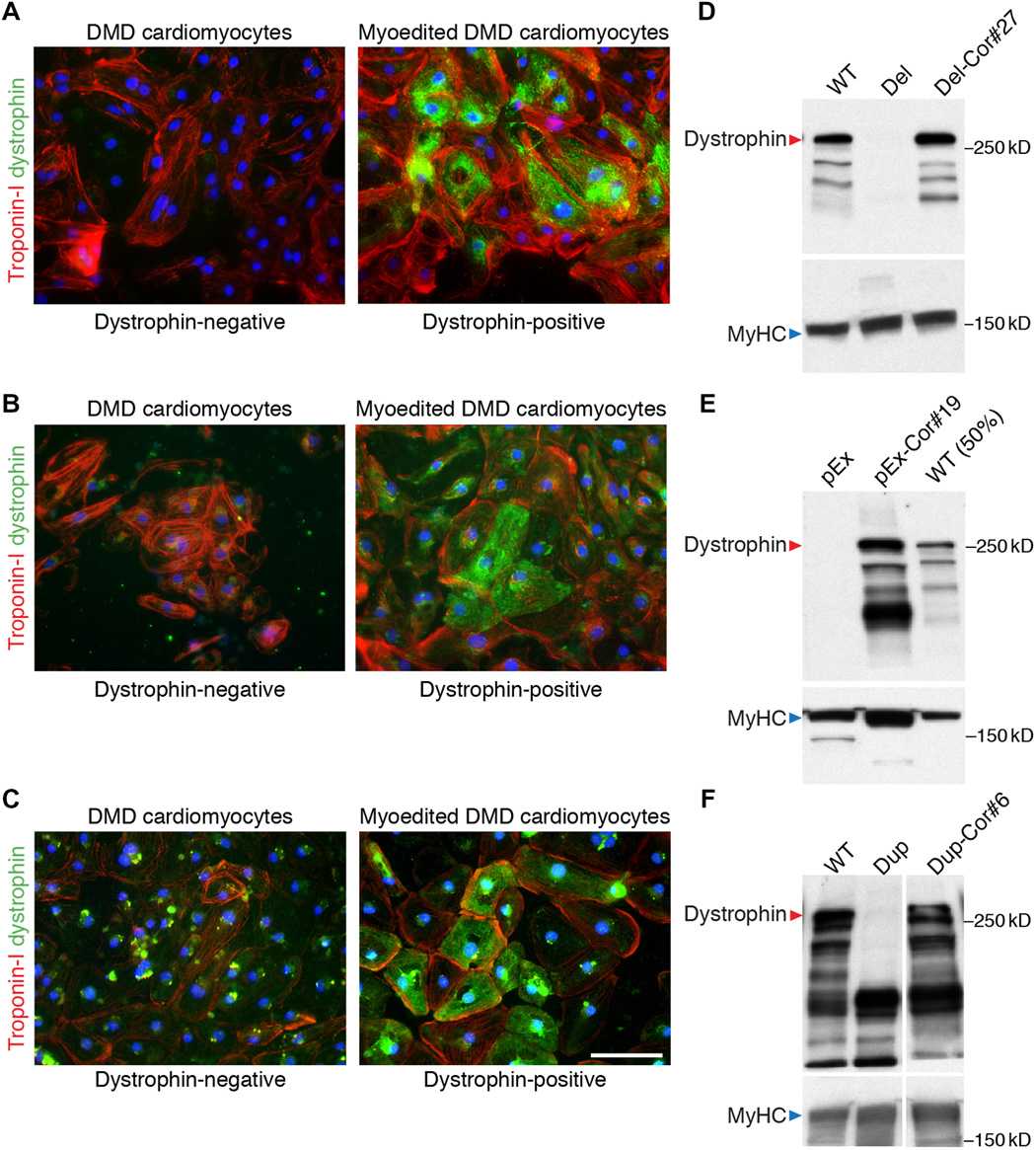
Чтобы проверить функциональность такой ткани, исследователи вырастили в чашке искусственную сердечную мышцу, смешав кардиомиоциты с клетками соединительной ткани. По сравнению с мышцей, выращенной из исходных мутантных клеток, «отредактированная» мышца нормально сокращалась. Ученые выяснили, что для поддержки сократительной функции достаточно, чтобы в составе мышцы было 30-50 процентов отредактированных клеток.
Свою технологию авторы работы назвали миоредактированием. Теоретически, она пригодна для доставки системы редактирования в сердечную мышцу пациентов при помощи вирусов (стандартное средство доставки в генотерапии), однако авторы рассматривают ее скорее как технологию для редактирования клеток пациента ex vivo с последующей имплантацией в сердечную мышцу. Технология редактирования клеток при помощи CRISPR-Cas9 вне тела пациента уже одобрена в Китае и США для лечения рака.
Исследование опубликовано в журнале Science Advances.
Освежить знания о принципах работы CRISPR-Cas9 можно в нашем материале.
Автор: Дарья Спасская