«Сознание того, что он жив, несмотря на то что умер много столетий назад, было само по себе большим испытанием. Тлейлаксианцы взяли клетки его мертвой плоти и вырастили существо в одном из своих чанов. Эти клетки начали размножаться и превратились в существо, имеющее его нынешнее тело».
Все гхолы Дункана Айдахо (а их у Бога-императора Дюны, прожившего больше трех тысяч лет, было немало) сложно переживали тот факт, что они — клоны. В конце 1960-х, когда Фрэнк Герберт придумывал для вселенной Дюны тлейлаксианские аксолотль-чаны, результаты первых экспериментов по созданию генетических копий животных были уже опубликованы. Но работало клонирование совсем не так, как у Бене Тлейлаксу. На то, чтобы воспроизвести технологию из книг Герберта, ученым потребовалось больше полувека — и сейчас они почти у цели.
Динозавры из лягушек
То, что сделал в 1958 году Джон Гердон, не было похоже на размножение клеток мертвой плоти. Его метод был гораздо ближе к тому, что делали в «Парке Юрского Периода» (который написали на несколько десятилетий позже), где динозавров выращивали из обломков их ДНК, «забивая» недостающие сегменты генами птиц, рептилий и земноводных.
У исходного организма — в первых экспериментах Гердона это был головастик — ученый брал лишь ядро одной из клеток, например, из стенки кишечника. Затем это ядро он подсаживал внутрь яйцеклетки, взятой от другой лягушки — и наблюдал за развитием головастика. Родное ядро яйцеклетки он при этом даже не удалял — потому что заметил, что в такой ситуации оно уступает руководство развитием подсаженному ядру. Убирать генетический материал донора ученые начали позже, когда речь зашла о полноценном клонировании животных.
Предшественники Гердона придумали метод переноса ядер совсем для других целей. Они подозревали, что по мере развития организма его клетки теряют «перспективность» — способность превращаться в разные клеточные типы. Пересадка ядра в яйцеклетку позволяла проверить эту гипотезу. Выяснилось, что если перенести в яйцеклетку ядро из клетки раннего зародыша, то у нее больше шансов развиваться нормально, чем если ядро взяли из клетки позднего зародыша — тогда почти точно ничего не получится.
Но Гердон обнаружил, что дело не столько в «сроке годности» клетки, сколько в недоработках метода. В его руках технология заработала с ядрами практически любого возраста — и тем самым превратилась в первый способ клонирования животных.
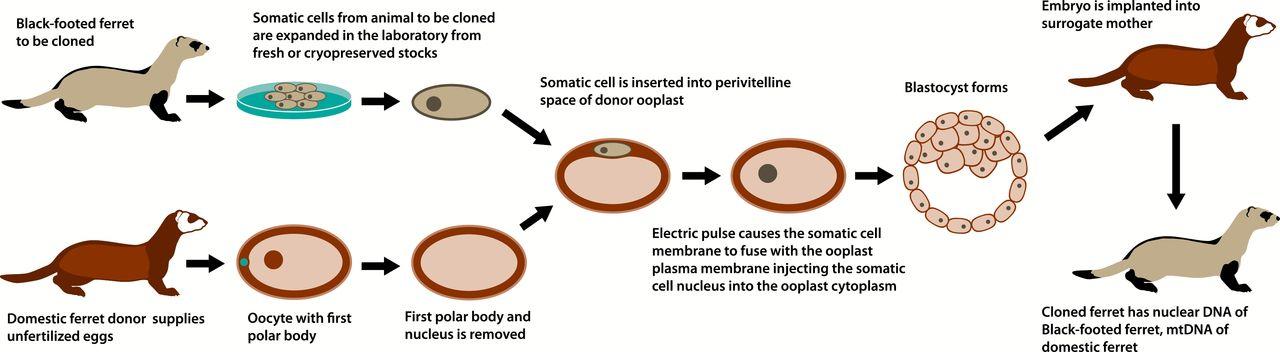
Клонировать млекопитающих взялись в середине 1990-х — и вскоре после этого договорились о том, что с людьми этого пробовать не будут. Поэтому даже не пришлось всерьез обсуждать, будет ли результат таких экспериментов настоящим клоном — вроде того, о котором писал Герберт. В методе Гердона есть один важный изъян: для того, чтобы вырастить клона, одного лишь ядра человеческой клетки недостаточно. Нужно найти еще женщину, которая станет донором яйцеклетки. А сама по себе ДНК не способна ни размножаться, ни развиваться — в соответствии с принципом XIX века: omnis cellula e cellula, клетка происходит только от клетки.
Поэтому в клетках клонов должна была с неизбежностью оказаться и чужеродная ДНК — из митохондрий материнской яйцеклетки. И хотя митохондриальные гены составляют лишь доли процента от общего клеточного генома, мы не смогли бы назвать таких людей точными генетически копиями оригинала.
Ребенку нужна бластоциста
Когда эксперименты с клонированием начались на млекопитающих, стало ясно, что в своих предположениях о «перспективности» ядер ученые в чем-то были правы. Забирая ядро из взрослого организма, мы переносим в будущий клон мутации, которые накопились в ДНК за годы жизни оригинала, и другие признаки генетического (и эпигенетического) возраста. И хотя мы до сих пор не знаем наверняка, повышает ли это «стартовый» возраст клона, известно, что многие такие клоны живут недолго. Овечка Долли, например, прожила в два раза меньше, чем положено обычной овце. А первых клонированных обезьян удалось получить только из ядер зародышевых клеток — клоны, полученные переносом «взрослых» ядер доживали лишь до появления на свет.
Чтобы научиться получать зародышевые клетки без помощи яйцеклеток, японец Синъя Яманака в 2006 году предложил технологию клеточного репрограммирования. Оказалось, что достаточно подействовать на клетки всего несколькими белками (или запустить работу соответствующих им генов), чтобы «обнулить» возраст клетки и превратить ее в эмбриональную стволовую, потенциальный источник любых клеток в организме.
Спустя шесть лет Яманаке, а по старой памяти и Гердону, присудили Нобелевскую премию. Официально — «за репрограммирование взрослых клеток в плюрипотентные», что можно прочесть как «за технологии клонирования». Берем клетку взрослого организма, превращаем ее в зародышевую, размножаем и получаем клеточную массу, из которой можно вырастить любой участок зародыша — как это еще назвать?
Выращивание отдельных частей организма — например, участка кожи или роговицы — из репрограммированных клеток сегодня так и называют: терапевтическое клонирование. Тем самым подчеркивая, что речь идет не о полноценных клонах, а лишь о методе лечения, когда человек становится источником запасных частей для самого себя. Для создания настоящих клонов есть отдельный термин — репродуктивное клонирование, и как раз оно сейчас запрещено.
Но даже если бы кто-нибудь сегодня отважился клонировать человека по методу Яманаки, ему все равно не удалось бы обойтись одной-единственной клеткой оригинала. Подобно тому, как клеточному ядру для развития было необходимо попасть в «тело» яйцеклетки, эмбриональные (и в том числе репрограммированные) клетки не могут расти без внезародышевых оболочек — амниона, аллантоиса и плаценты. Они нужны, чтобы прикрепить будущий зародыш к стенке матки, снабжать его едой и кислородом, а главное — сигналами о том, где у него, например, верхняя и нижняя сторона. Лишенные этой информации клетки зародыша вынуждены лепить из себя будущее существо вслепую — и у них никогда не получается принять форму эмбриона человека.
Поэтому репрограммированные клетки пришлось бы подсадить в уже существующий эмбрион на стадии бластоцисты, когда внезародышевые клетки уже образовали клеточный шар. В результате у вас получился бы гибрид: внезародышевые ткани от одного организма, а зародыш — от другого. Эта конструкция больше похожа на то, что происходит в фильме «Чужой: Воскрешение», когда клон Эллен Рипли раз за разом вырастает химерой, из которой не получается отделить гены Чужого. Насколько «скрещивание» эмбрионов сказалось бы на генетической идентичности человеческого клона мы, к счастью, не знаем — но допускаем, что чужеродная ДНК могла бы попасть внутрь зародышевых клеток. И неизвестно, удалось бы тогда ее отделить от собственных генов клона.
Как сделать гхолу
Клоны, которых мы могли бы создавать по методу Гердона или Яманаки, были бы «несамостоятельными». Биоматериала, забранного у оригинала, не хватало бы на то, чтобы вырастить полноценную копию. Чтобы реализовать предсказание Герберта, не хватало следующего шага: научиться превращать одну клетку взрослого организма в несколько типов клеток сразу — зародышевые и внезародышевые — и склеивать их в единую конструкцию.
Первым эту проблему решил в 2019 году испанский биолог Хуан Карлос Исписуа Бельмонте, известный своими смелыми экспериментами (среди других его заслуг, например, создание химерных зародышей человека и обезьяны). Он брал клетку из организма взрослой мыши, репрограммировал ее, размножал и получал культуру зародышевых стволовых клеток. Затем он репрограммировал их еще «дальше», откатывая к состоянию, когда из клетки может получиться или зародыш, или внезародышевая ткань. А потом на культуру таких клеток действовал смесью сигнальных веществ: одни заставляли клетки стать зародышевыми, а другие — внезародышевыми. Получалась смесь, из которой вырастало нечто, похожее на бластоцисту — бластоид — и его даже удавалось имплантировать в мышиную матку. Так у Бельмонте сложился третий способ клонирования животных.
Теперь его успехи удалось повторить и с клетками людей. Причем это сделали одновременно сразу три группы. Исследователи из Австралии и Техаса опубликовали свои отчеты в новом номере Nature, а ученые из Калифорнийского технологического университета пока только выложили препринт на портал biorXiv — зато успели на несколько дней раньше.
Их методы незначительно различаются между собой, но в основе их одна и та же идея: репрограммировать клетки, подействовать на них разными сигнальными веществами и собрать в бластоид на трехмерной подложке. У всех исследовательских групп получились конструкции, которые по морфологии и экспрессии генов напоминали человеческие бластоцисты. А поскольку проверять их жизнеспособность имплантацией в матку запрещено законом, ученым пришлось имитировать имплантацию in vitro — это, конечно, еще не аксолотль-чаны Бене Тлейлаксу, но логика та же.
На этом месте в экспериментах с зародышами возникают неизбежные трудности: их нельзя культивировать дальше 14-го дня развития (о том, почему это так, мы подробно рассказывали в материале «14 дней спустя»). А поскольку бластоид — это не настоящая бластоциста, то не очень понятно, какому дню развития он соответствует и в какой момент стоит остановить эксперимент. Поэтому обе группы продержали свои бластоиды в течение трех-четырех дней после имплантации и завершили эксперимент. Однако они успели заметить, что их искусственные эмбрионы проходят примерно те же стадии развития, которые положено пройти настоящим зародышам в утробе матери.
Как и положено свежей технологии, «тлейлаксианский» метод клонирования пока выглядит довольно сырым. Бластоиды получаются не каждый раз, в них не всегда появляются все необходимые типы клеток, а их геометрию непросто контролировать. Наконец, пока не родилась даже первая мышь, клонированная новым способом — что уж говорить о человеке. Тем не менее, у разработчиков большие планы на будущее. Они обещают отточить технологию до такой степени, чтобы бластоиды стали идентичны человеческим бластоцистам (и на них можно было, например, изучать последствия генетической модификации) — и прозрачно намекают: создание таких зародышей потребует пересмотра нынешнего законодательства об экспериментах над эмбрионами.
Это законодательство и без того нуждается в пересмотре, и Международное общество исследования стволовых клеток обещает опубликовать новую версию рекомендаций этой весной. Однако, как отмечают авторы редакционной заметки в Nature, эксперименты над искусственными эмбрионами могут вызывать меньше сочувствия публики, чем манипуляции с настоящими зародышами — хотя, если по строению они окажутся идентичны, у них будут точно так же биться сердца, двигаться диафрагма и передаваться нервные импульсы. Придется ли для них прописывать отдельные правила или ученые договорятся обращаться со всеми эмбрионами одинаково, вне зависимости от их происхождения?
Когда Пол Атрейдес впервые встречается с гхолой своего погибшего друга и учителя Дункана Айдахо, он колеблется. Перед ним стоит не Айдахо, но его тело. В долгу ли он перед искусственно созданной плотью, «в которой ложь мешается с истиной»? Сегодня, когда мы вплотную приблизились к созданию того, что могло бы быть настоящим гхолой, вопрос о том, что намешано в плоти, встает и перед нами. И по мере того, как методы клонирования будут совершенствоваться, нам придется пересматривать не только свое представление о том, где начинается неповторимость человека (которую уже не получится определять через сумму его генов), но о том, где начинается его жизнь — особенно тем из нас, кто отсчитывает ее от встречи сперматозоида с яйцеклеткой.
Автор: Полина Лосева