Исследователи из Калифорнийского технологического института опубликовали трехмерную структуру мембранного белкового комплекса бактерии Legionella pneumophila, который участвует в транспорте наружу токсинов и генов устойчивости к антибиотикам.
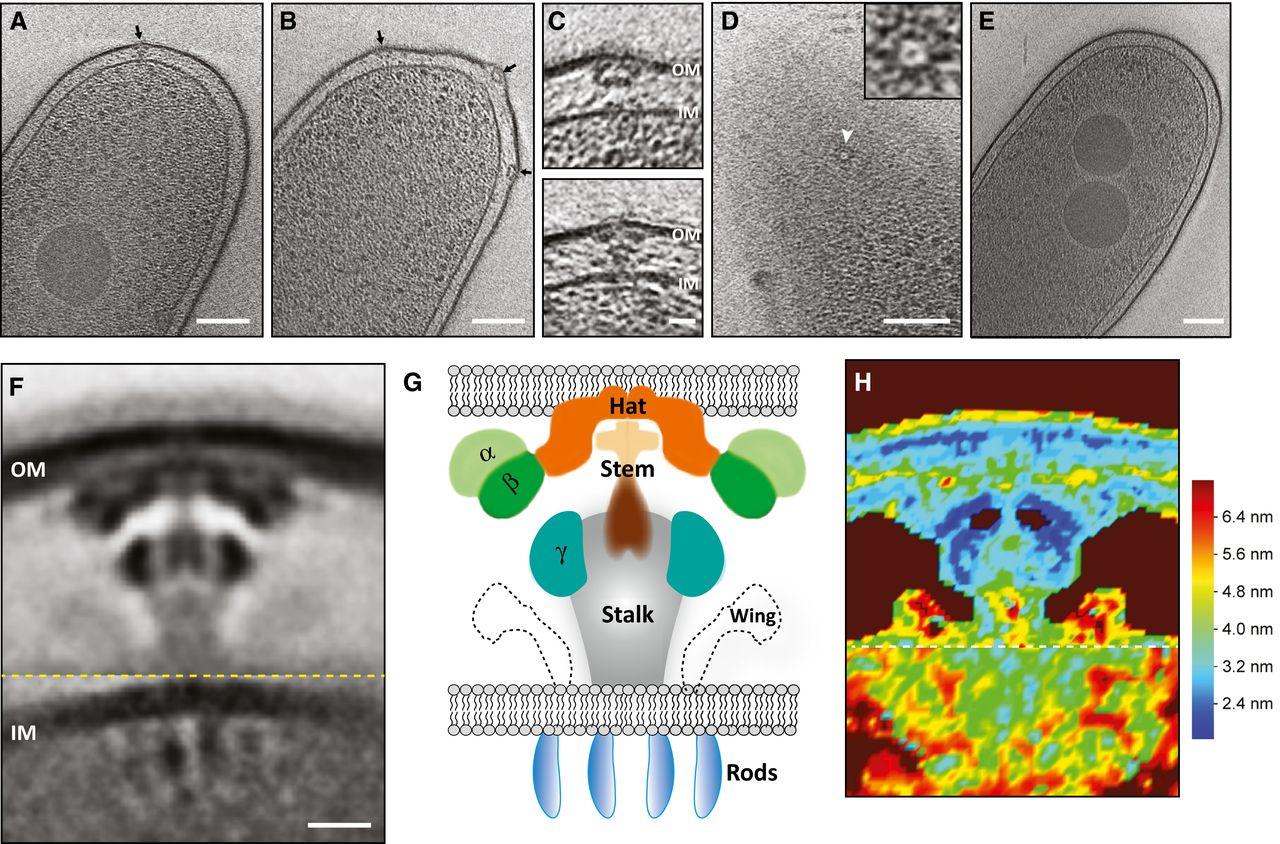
Структура такого комплекса была впервые разрешена in situ, то есть непосредственно в мембране бактерии. Статья вышла в журнале EMBO Press.
Грам-отрицательные бактерии, к которым принадлежит и легионелла, окружены двойной мембраной, поэтому для того, чтобы транспортировать через нее что-либо во внешнюю среду, они обзавелись сложным аппаратом секреции. Системы секреции представляют из себя многосубъединичные наномашины, которые с затратой энергии могут выбрасывать в окружающую среду довольно крупные молекулы, такие как белки и ДНК. Патогенные бактерии используют их для транспорта наружу токсинов и различных белков, помогающих им паразитировать на хозяине. Также системы секреции используются для горизонтального переноса генов, то есть обмена ДНК. Распространение устойчивости к антибиотикам происходит именно таким путем. Выделяют шесть типов систем секреции, и самой многофункциональной из них является система секреции типа IV, включающая в себя несколько подтипов белковых комплексов.
Легионелла, которая послужила модельным объектом в данном исследовании, является патогенной бактерией и вызывает тяжелую разновидность воспаления легких (легионеллез, или болезнь легионеров). Она живет в клетках иммунной системы, и для того, чтобы успешно паразитировать, выделяет внутрь хозяйской клетки около трехсот различных белковых молекул. Для этого легионелла использует комплекс Dot/Icm, являющийся разновидностью системы секреции IVB подтипа. В отсутствие комплекса бактерия перестает быть патогенной. Возможно, ингибиторы систем секреции были бы перспективным классом антибиотиков, предотвращая выброс бактериями факторов вирулентности и обмен генами устойчивости к антибиотикам, но для их эффективной разработки недостаточно данных о механизме работы этих систем и их структуре. В 2014 году в журнале Nature была опубликована реконструированная из отдельных белков структура подобного комплекса кишечной палочки, но в новой статье исследователям из Калтеха удалось исследовать секреторный аппарат непосредственно в мембране бактерии. Для этого авторы воспользовались методом электронной криотомографии. Множество двумерных снимков мембран замороженных бактерий, полученных с использованием электронной микроскопии, объединили при помощи программного обеспечения. В результате обработки изображений 386 частиц получилась усредненная томограмма комплекса, разрешение которой авторы оценили как 2,5-4,5 нанометра. Такое разрешение вполне позволяет оценить общую структуру комплекса и его расположение в мембране. Чтобы убедиться, что разрешен именно комплекс Dot/Icm, ученые сравнили снимки «диких» бактерий и лишенных комплекса, в мембране которых подобных структур не наблюдалось.
Полученную в работе трехмерную модель секреторного аппарата легионеллы авторы работы сравнили с недавно опубликованной моделью комплекса cag другой патогенной бактерии Helicobacter pylori, который принадлежит к подтипу IVA (эта модель была построена на основе реконструированного комплекса, т.е. in vitro). Несмотря на отсутствие сходства в последовательностях ДНК, кодирующих субъединицы комплексов, они оказались довольно похожи по трехмерной структуре.
Общность механизмов, определяющих патогенность у различных бактерий, означает, что их, вероятно, можно универсальным способом заблокировать. Среди существующих классов антибиотиков пока нет препаратов, подавляющих секреторный аппарат бактерий, хотя в поисках новых способов борьбы с ними ученые взялись даже за кленовый сироп.
Автор: Дарья Спасская