Совместной российско-американской группе биологов удалось обнаружить новый тип бактериального иммунитета на основе CRISPR. В отличие от уже известных систем, он работает только на уровне РНК, что весьма необычно и, потенциально, может быть интересно для терапии рака.
Ко всему, что связано с CRISPR, сейчас приковано огромное внимание и поток новых статей (как научных, так и в СМИ) растет в геометрической прогрессии. Мы уже неоднократно писали об этой технологии, но на этот раз решили чуть более обстоятельно остановится на науке, которая за ней стоит. И поговорить не только о принципах редактирования генома, но и о том, какие последние веяния существуют в этой области. Обо всем этом нам рассказал один из авторов новой статьи, профессор Сколтеха и Университета Ратгерса, зав. лабораториями в ИМГ и ИБГ РАН, Константин Северинов.
Наши читатели уже наслышаны о технологии CRISPR/Cas9 и кое-что о ней знают: что это новый метод редактирования геномов, что его можно использовать для лечения наследственных (и не только) болезней, что в некоторых странах уже начинаются его клинические испытания, и что вся эта технология основана на открытии системы антивирусного иммунитета бактерий, которая работает как своеобразная «картотека» фрагментов вирусной ДНК (освежить свои знания можно здесь). Но если посмотреть подробнее, то оказывается, уже сейчас известны несколько разных типов и классов CRISPR-систем, у которых разная и своеобразная биология. Чем отличаются эти классы друг от друга?
В принципе, разные CRISPR системы это, как говорят по-английски, разные способы снять шкуру с кошки. Все они — результат нескончаемой войны между бактериями и их паразитами. Объединяет CRISPR системы то, что они являются системами адаптивного иммунитета. Адаптивность в данном случае означает, что система может захватить фрагмент генетической информации паразита (это может быть не только вирус, но и плазмида или какой-то другой мобильный генетический элемент) и встроить его в CRISPR-кассету, которая является частью генома бактерии. И такой благоприобретенный фрагмент будет работать, как молекулярная память, позволяющая потомкам бактерии обнаруживать и предотвращать инфекции «запомнившимся» паразитом.
Даже такое поверхностное описание подразумевает существование двух стадий действия CRISPR систем: стадию адаптации, то есть приобретения «молекулярной памяти», и стадию ее применения — что вы с этой памятью делаете, как вы ее используете для борьбы с паразитами. Так вот, единственное, что объединяет разные типы CRISPR систем, — это модуль адаптации. Его составляют два белка Cas1 и Cas2, которые отвечают за захват чужеродной генетической информации и встраивание ее в CRISPR-кассету. Эти белки закодированы во всех CRISPR системах.
А вот когда первая задача решена, когда необходимая информация в CRISPR кассете уже есть, уничтожать паразита можно самыми разными способами. В ходе эволюции было несколько случаев соединения одного и того же модуля адаптации с различными модулями интерференции — «машинками» для уничтожения чужеродной генетической информации. В результате возникли разные классы и типы CRISPR-систем. Реконструкцией их естественной истории сейчас активно занимается один из соавторов нашей статьи, биоинформатик Евгений Кунин.
Классификация CRISPR-систем основана на различиях в модулях интерференции, исполнителях или экзекуторах. Эти исполнители должны уметь много чего делать: сначала они должны физически провзаимодейстовать с хранящимся в CRISPR кассете «воспоминанием» в виде РНК, затем донести его до мишени, примерить к ней и, в случае совпадения, уничтожить эту мишень. Есть два класса CRISPR-систем: у класса II все экзекуции делает один, но очень большой белок, у систем класса I эти функции разделены между несколькими отдельными, разными белками, каждый из которых играет свою собственную роль. Широкую известность получили только системы второго класса, где все делает один белок-многостаночник. Просто потому, что с точки зрения практических применений с одним белком работать гораздо проще, чем с десятком.
Внутри каждого класса выделяют несколько типов исполнителей, которые объединяются по принципу общности происхождения. Есть, например, белок Cas9, который сейчас широко используется при редактировании геномов, а есть белок Cpf1, который делает примерно то же самое и имеет примерно такой же размер, но устроен по-другому и не является родственником белкам Cas9. Ситуация примерно такая же, как с крыльями у бабочек, птиц и летучих мышей: они делают одно и то же, но имеют совершенно разное происхождение.
Новая система, которую мы совместно с Евгением Куниным и Фенгом Жангом нашли и описываем в нашей статье, похожа на CRISPR/Cas9 по своей работе, по идеологии, но не родственна ни ей, ни Cpf1. Нахождение и уничтожение мишени осуществляется новым, ранее неизвестным белком, названным C2c2. А так как он неродственный, то и делает он все по-другому. Это не значит, что он обязательно будет работает лучше известных белков, но у него могут быть преимущества, важные для биотехнологии и медицины.
Системы первого класса (I, III и IV типа) — многосубъединичные. С точки зрения биологии, на мой взгляд, они гораздо интереснее (потому что они сложные, сложность всегда захватывает, ее интересно понять), но с точки зрения практического применения, конечно, с ними работать тяжелее. Поэтому биотехнологи их пока избегают. Хотя в принципе, из-за разделения функций весь процесс поиска, анализа и уничтожения мишени в таких системах становится гораздо более точным.
Что, казалось бы, как раз очень хорошо для геномного редактирования?
Да, хорошо, но уж очень эти системы сложные и громоздкие. Ведь для того, чтобы редактировать геном, вам надо упаковать весь эксекуторский инструментарий в какое-то средство доставки в эукариотическую клетку. Например, в аденовирус. А «грузоподъемность» аденовируса, фактически, длина генов, которые можно упаковать в вирусную оболочку, к сожалению, очень ограничена.
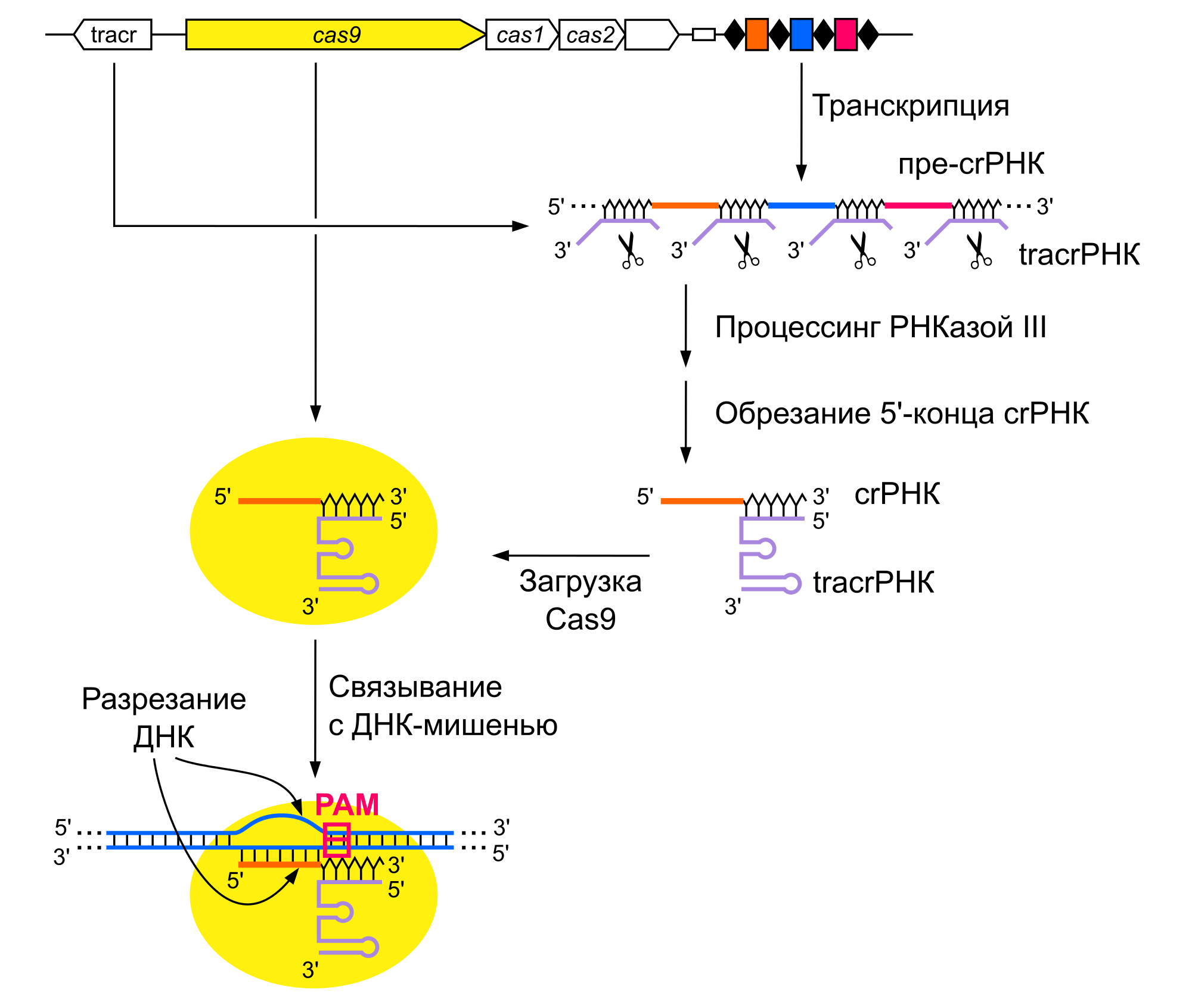
Тем не менее, среди многосубъединичных систем есть очень интересные. Например, системы III типа, которые в качестве мишеней действуют не на ДНК, а на РНК. Зачем это нужно? Дело в том, что многие вирусы действуют очень хитро — при проникновении в клетку они первым делом встраивают свой геном в геном клетки, становятся его частью. И сидят там, тише воды, ниже травы, представляя клетке возможность делиться, и следовательно, увеличивать количество вирусных геномов. Если у вас в CRISPR кассете есть память о таком вирусе, то система его найдет и, естественно, уничтожит . И собственная клеточная ДНК попадет «под раздачу» вместе с вирусной, клетка погибнет. Поэтому «умные» системы III типа ищут мишень не собственно в геноме, а только среди работающих копий генов, тех, которые производят РНК. До тех пор, пока вирус в геноме сидит тихо и ничего не делает, его гены неактивны и система иммунитета его не видит и не трогает. Как только вирус начинает размножиться, синтезировать вирусную РНК (на основе которой потом получатся белки и вирусные частицы), клетка «понимает», что с ней происходит что-то очень нехорошее и пора действовать. CRISPR системa III типа активируется и уничтожает вирус, правда, заодно, уничтожив и клетку-носителя.

Примерно так же работает система на основе белка C2c2, которую вы сейчас нашли. Но прежде чем говорить о ней, расскажите, как бы организован поиск, как вы вообще научились искать новые системы CRISPR? Насколько я понимаю, для этого был сделан специальный поисковик, который описан в вашей предыдущей статье, так?
Да, его сделал Сережа Шмаков, который сначала учился в Бауманке, потом работал в Майкрософте, потом пришел в вечернюю Школу анализа данных Яндекса, где научился работать с геномными данными. А потом я убедил его пойти в Сколтех, потому что в Майкрософте ему стало скучно.
То, что он сделал, довольно просто объяснить исходя из того, о чем мы уже говорили. Все CRISPR системы должны иметь адаптационный и интерференционный модули. И первый из них у всех известных систем фактически одинаковый — он состоит из гомологичных белков Cas1 и Cas2. Поисковик, который написал Сережа, делает три вещи. Во-первых, он находит в базах геномых последовательностей все куски ДНК, кодирующие белки, похожие на Cas1. Во-вторых, поисковик смотрит на последовательности, расположенные поблизости, и выбрасывает уже известные CRISPR-эффекторы, они нам не интересны. И, в-третьих, поисковик ищет в последовательностях, примыкающих к предсказанным Cas1 генам ,любые большие гены — просто потому, что мы считаем что белок, который мог бы справится со всеми функциями CRISPR эффектора, должен быть достаточно большим. Вот и все, в три шага мы получаем список кандидатов в «новые Cas9».
После того, как список кандидатов готов, наступает момент открытия карт. Если мы действительно научились правильно искать эффекторы CRISPR, эти белки-многостаночники, то где-то рядом с ними должны быть кассеты, в которых хранится память о вирусах. Мы эти кассеты специально не искали, их присутствие на заложено в алгоритм поиска, но они там должны быть просто исходя из логики работы системы. И действительно, они там обнаруживаются, т.е., мы на верном пути.
А можно было бы действовать наоборот — искать кассеты и находить эффекторы.
Да, такой поисковик сейчас тоже сделан. Так вот, среди списка кандидатов мы нашли три совершенно новые группы эффекторов. Они получили названия кандидаты-1, 2, и 3 (C2c2 это просто «класс 2 кандидат 2»). В нашей первой статье в Molecular Cell, мы подтвердили, что C2c1 действительно работает. Что при переносе в кишечную палочку такая система, предсказанная нами в геноме совершенно другой бактерии, действительно защищает от инфекции чужеродной ДНК, а сам C2c1 эффектор действительно «раскусывает» ДНК, соответствующую участкам CRISPR кассеты в пробирке и так далее.
Новый белок довольно интересен с биотехнологической точки, как замена Cas9. По двум причинам: у него, в отличие от Cas9, оказался другой вид «раскуса» ДНК мишени, более подходящий для редактирования генома. Во-вторых, у него другая специфичность к дополнительным нуклеотидам, то есть к PAM. Такая специфичность значительно ограничивает применимость Cas9 для редактирования генома.
Что такое PAM?
PAM (protospacer adjacent motive, «мотив, прилегающий к протоспейсеру») — это одна из самых интересных штук во всей CRISPR кухне. Интересная прежде всего тем, что ее можно было бы открыть на кончике пера, без каких-либо экспериментов. Впервые на ее существование обратил внимание Франциск Мохика (Francisco Mojica), — потрясающе умный, но совершенно не «раскрученный» человек в этой области. Он, кстати, предложил термин «CRISPR».
Смотрите, если бактериальный иммунитет работает так, как я вам рассказал, то вы сами должны догадаться, что такое PAM. Итак, у вас есть кассета с фрагментами вирусных ДНК (спейсерами), с кассеты синтезируется РНК, РНК связывается с эффектором и, если спейсер CRISPR РНК совпадает с мишенью, такая мишень будет уничтожена. Ясен пень, что первое, с чем произойдет совпадение, — это сама кассета в геноме, с которой РНК синтезировалась. Получается, что бактерия будет вынуждена сама себя убить? Вроде бы да, но этого не происходит, и вот почему.
Дело в том, что белку-эффектору, чтобы начать разрезать ДНК, недостаточно полного совпадения направляющей РНК с мишенью. Нужно соблюсти еще одно условие: к мишени должна прилегать особая короткая последовательность, которая говорит белку, что это — не собственный геном. В геномной кассете рядом со спейсером находится повтор, который белок-эффектор чувствует, как «свое». Если такая же последовательность есть в мишени, она не будет разрезана. Это всего несколько нуклеотидов, но их оказывается достаточно, чтобы спасти мишень. Чтобы мишень была разрезана, к ней должна прилегать какая-то совсем другая последовательность, максимально не похожая на то, что есть кассете. Такая последовательность и есть РАМ. Она обеспечивает распознавание «свой-чужой».
Способность распознавать PAM встроена в белок-эффектор. Понятное дело, что для биотехнологии это означает, что мы вообще говоря не можем редактировать любые участки генов. Только те, где есть подходящий PAM, а это сильно сковывает руки.
И поэтому нужные новые эффекторы, которые вы и ищите. Расскажите о нуклеазе C2c2, которую вы нашли в новой статье. Что она из себя представляет, как работает?
Это эффектор, который действует исключительно на уровне РНК. В отличие от систем типа III, которые РНК-зависимые, но режут ДНК, С2с2 действует только на РНК. У такой системы есть свои достоинства. Вы в новости об этом писали, и мы тоже упоминали это в статье — что ее можно потенциально использовать для действия на клеточные РНК или чего-то подобного. Но, боюсь, на самом деле она не будет иметь практического значения, к сожалению. Зато с точки зрения фундаментальной науки эта система очень красивая.
Мы ведь с вами говорим об иммунитете одноклеточных организмов, который принципиально отличается от нашего собственного иммунитета. У одноклеточных, в клональной популяции (где почти все индивидуумы генетически идентичны друг другу), все устроено примерно как в сталинском обществе: жизнь каждой отдельной клетки — ничто. Если идет вирусная инфекция, то популяции выгоднее дать зараженным клеткам умереть, но не допустить распространение вируса по популяции, чем как-то пытаться спасти отдельную зараженную клетку.
И как же C2c2 убивает пораженные клетки?
У военных есть такое понятие — collateral damage, «сопутствующие потери». Это когда, например, американцы бомбили Белград, а попали не только куда целились, но и заодно в китайское посольство. Вот тут работает примерно так же. Эффектор C2c2 узнает РНК-мишень и, как и Cas9, разрезает ее — но, в отличие от последней, разрезает не там же где узнает, а в другом месте РНК.
Мы начали это изучать и оказалось, что у C2c2 узнавание мишени не приводит к точному разрезанию, а является просто сигналом о том, что в клетке появилась вирусная инфекция. И как только такой сигнал получен, клетка решает свести счеты с жизнью и эффектор начинает уничтожать всю имеющуюся в клетке РНК. Зараженная бактерия, конечно погибает. Вместе с вирусом. Понятное дело, что для геномного редактирования на уровне отдельных генов эта не слишком подходит.
Да, но ее можно использовать для того, чтобы уничтожать клетки, экспрессирующие «неправильные» РНК. Например, характерный для многих опухолей альфа-фетопротеин или другие онкомаркеры?
Да, об этом можно подумать — если бы, например, удалось найти такой транскрипт, молекулу РНК, которая характерна только для опухоли. В принципе, сама по себе C2c2 очень точная, мы это проверяли — одного несовпадения достаточно для того, чтобы предотвратить ее ложное срабатывание. Так что в принципе, то что вы предлагаете возможно , но не как система подавления активности конкретных генов по типу РНК-интерференции, а именно, как наведенная, программируемая клеточная смерть. Другая парадигма.
Вы, как я понимаю, не слишком гонитесь за применимостью в медицине того, что изучаете?
Я — точно нет. А вот один из наших соавторов, Фенг Жанг, вполне себе да. Он хочет вылечить людей от рака, управлять мозгом и т. д. Мне все это интересно прежде всего тем, что позволяет на волне CRISPR-сумасшествия изучать новую биологию, сдвигать границу познанного. Что касается поиска новых эффекторов в качестве замены Cas9 в биотехнологии, то они уже есть и их становится все больше.
Например, активно начинает использоваться [найденный Жангом и соавторами] Cpf1. Поисковик, о котором мы только что говорили, дал нам еще 5-6 совершенно новых кандидатов, которые надо еще исследовать и исследовать. Можно пойти по другому пути и улучшать уже известные Cas9 белки, как это было сделано недавно — когда увеличили его точность за счет замены нескольких аминокислот. Или когда уменьшили размер природного белка, удалив из него 20% аминокислот. Представляете, статья в Nature о том, как в гене делецию сделали? Курсовая работа, в лучшем случае. С одной стороны — смешно, с другой — места в аденовирусе, с помощью которого делают доставку в клетки, стало гораздо больше. С точки зрения биотехнологии это очень важно.
И, тем не менее, вы свою статью перед публикацией выложили в bioArxive. Очевидно для того, что бы гарантировать приоритет для последующих применений?
Да, и для этого тоже. И патент мы на это дело получили — совместный с MIT, Университетом Ратгерса и Сколтехом.
Расскажите о конференции в Израиле, с которой только что вернулись. Я так понимаю, что там были все: и первооткрыватели CRISPR, и те компании, которые пытаются превратить биотехнологию в терапию. Что сейчас происходит в «CRISPR-ном бизнесе»? Ну, помимо того, что там крутятся безумные деньги?
О деньгах как раз речи не было, потому что это чисто фундаментальная некоммерческая конференция. Которую, кстати, поначалу придумали и поддерживали вовсе не компании вроде EDITAS (американский стартап, который собирается одним из первых применять технологию CRISPR/Cas9 для терапии), а американские военно-воздушные силы.
Тем не менее, по общению как с «фундаментальными», так и с «коммерческими» людьми сейчас совершенно очевидно, что основная проблема технологии — это биоинформатическое предсказание мишеней для направляющих РНК при редактировании тех, или иных генов человека, животных и растений. Дело в том, что точное узнавание не сводится только к соответствию мишени и РНК, наличию в гене PAM-а или наличию у эффектора ошибочной (off-target) активности. Чтобы найти хорошую направляющую РНК для редактирования генома надо учитывать и состояние хроматина, и положение нуклеосом и транскрипционную активность в данном месте генома и, скорее всего, массы других факторов. Сейчас все занимаются тем, чтобы придумать компьютерную модель предсказания правильных мишеней и направляющих РНК.
Хотят превратить это предсказание в сервис?
Да, в сервис для конечного потребителя. Главная проблема во всем этом бизнесе — не только и не столько научиться вносить мутации эффективно, но добиться того, чтобы они были правильными. Потому что после внесения разрывов могут происходить разные события — может возникать делеция в данном месте гена (ген будет сломан), или, наоборот, произойдет замена на заранее подобранную «правильную» копию гена. По какому сценарию пойдет этот процесс, предсказать сейчас сложно. Это зависит от массы факторов: от направляющей РНК, от типа эффектора, от состояния клетки и так далее. Будет много данных — будем анализировать. Сережа Шмаков организовал недавно в Москве хакатон по этой задаче, пытаясь найти факторы, которые на это влияют.
Машинное обучение?
Именно, машинное обучение. На эффективность процесса может влиять контекст мишени (локальный или глобальный), кинетические параметры, что угодно. Есть экспериментальные данные, и можно эти параметры выявлять, а потом делать предсказания и проверять их, юстируя систему.
Но из всего этого следует, по-видимому, что недавно начатый патентный спор о принадлежности технологии CRISPR уже ни на что не повлияет?
Да, это как с рестриктазами — никто на них особых денег не сделал. Сам по себе защищенный патентом Cas9 это только малая часть истории. Патент на него легко обойти, проблема не в этом. Основная интеллектуальная собственность будет заключена в конкретных направляющих РНК, которые будут использоваться для лечения конкретных болезней. До этой стадии пока еще никто не добрался, так что в этом смысле главная дележка еще не началась.
Какие болезни человека будут первыми при терапии CRISPR?
Все хотят лечить болезни сетчатки глаза. И Синья Яманака (нобелевский лауреат, первооткрыватель метода получения индуцированных стволовых клеток) этим занимается, и EDITAS. В глаз проще вводить генетические конструкции. Плюс к тому печень и мышцы: мышечная дегенерация как раз хороший вариант тестовой болезни, так как можно просто сделать укол в мышцу и даже небольшой процент вылеченных клеток будет играть роль для терапии. И, конечно, кровь, — химерные рецепторы Т-клеток все хотят делать.
А что по поводу редактирования генома эмбрионов, вмешательства в половую линию человека?
Дженнифер Дудна по этому поводу делала большой доклад (один из авторов технологии редактирования геномов). Вывод, в общем, в том, что даже она (при том, что всегда была резко против), признает, что распространение технологии уже никак не остановить. Что бы мы по этому поводу не думали. Кстати, она сказала, что в ближайшее время работы по модификации половой линии разрешит Калифорния.
Я только никак не могу понять, почему вмешательства в половую линию следует бояться? Вы-то мне можете объяснить, почему это опасно?
Честно говоря, я тоже не знаю. Это как с ГМО. Бояться надо только невежества, как мне кажется.
Беседовал Александр Ершов