Исследователи из МФТИ и ряда институтов США и Китая сумели расшифровать структуру одного из важнейших белков нервной системы в комплексе с несколькими лекарственными молекулами.
Эта работа открывает возможности для разработки новых лекарств с контролируемым действием и сниженными побочными эффектами. Исследование опубликовано в журнале Cell.
«Волшебная пуля» против «волшебного дробовика»
Многие современные лекарства действуют на белки. Это обусловлено тем, что именно белковые молекулы делают в клетке большую часть физической и химической работы, являются приёмниками и передатчиками информации между клетками и так далее. При болезни слаженная работа белков нарушается, а лекарство позволяет восстановить равновесие, на время притормозив или усилив их работу. Многие белки, выполняющие схожую функцию, часто устроены почти одинаково, и одна и та же молекула лекарства может действовать на несколько их типов. Способность лекарства взаимодействовать с несколькими типами белков называется полифармакологией.
На заре молекулярной эры в разработке лекарств среди учёных господствовало мнение, что эффективность препарата обеспечивается воздействием на один конкретный тип белков в организме. Воздействие на все прочие типы вызывает лишь побочные эффекты, с которыми врачам приходится бороться. Поэтому главная задача всей фармакологии на тот момент заключалась в придании новым лекарственным веществам максимальной селективности — способности действовать лишь на один тип белков. За этой концепцией закрепилась удачная метафора нобелевского лауреата Пауля Эрлиха, назвавшего высокоселективные препараты «волшебной пулей».
Однако, как часто случается в науке, самая простая концепция оказалась не обязательно самой успешной. Развитие компьютерных технологий в химии и биологии позволило получать очень селективные препараты, ограниченные лишь 2–3 близкими подтипами белка-мишени, но их эффективность в случае некоторых сложных заболеваний вроде депрессии резко снижалась по сравнению с низкоселективными аналогами. Полифармакология некоторых препаратов оказалась важной составляющей их действия. Она не обязательно должна вызывать серьёзные побочные эффекты, однако необходимо тонко управлять тем, на какие белки действует лекарство. На смену «волшебной пуле» пришёл «волшебный дробовик» — лекарство, воздействующее должным образом на нужный набор мишеней.
Точки крепления
Задачей исследователей из МФТИ и их зарубежных коллег было выявление структурных особенностей белков, благодаря которым некоторые лекарства действуют на них селективно, а другие — нет. Для работы был выбран серотониновый рецептор 5-HT2c — сигнальный белок, расположенный в мембране клеток и получающий сигнал от соседей с помощью гормона серотонина. Он имеет ряд важных особенностей. Во-первых, этот рецептор уже является важной мишенью в терапии ожирения и, потенциально, ряда психических заболеваний. Во-вторых, для него существует множество препаратов с очень разной селективностью, которые можно сравнить между собой. В-третьих, в организме человека есть ещё около 800 рецепторов, которые отдаленно похожи по строению на 5-HT2c (они относятся к классу семиспиральных рецепторов или GPCR), но выполняют разные функции, поэтому неселективные препараты к нему часто вызывают внушительный букет разнообразных побочных реакций.
Всеволод Катрич, приглашённый профессор МФТИ, поясняет:
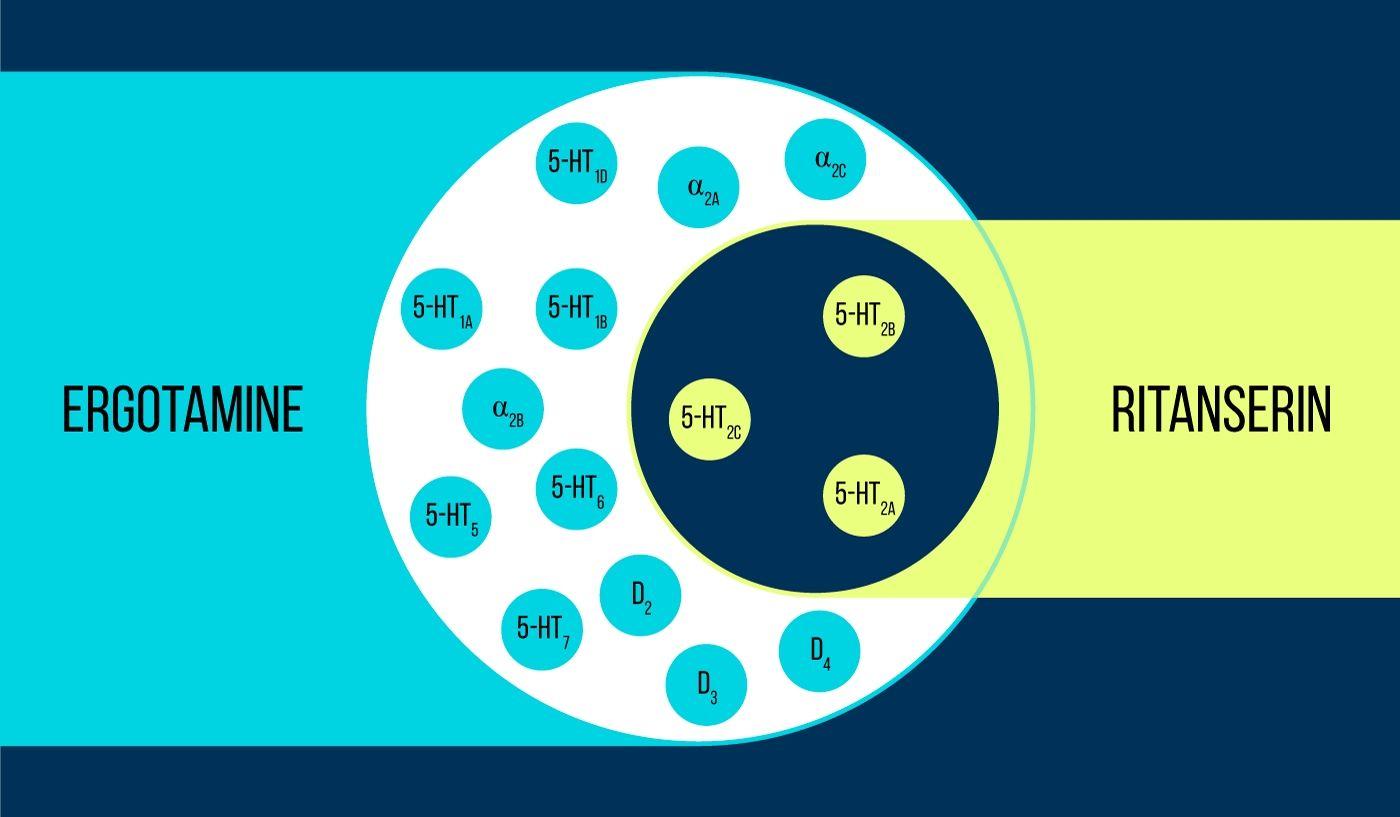
«Для работы с серотониновым рецептором 5HT2c использовали 2 препарата: эрготамин и ритансерин. Эрготамин — это неселективный агонист, который обладает широким полифармакологическим профилем, действуя на серотониновые, дофаминовые и адренергические рецепторы. Ритансерин, напротив, обладает более узким полифармакологическим профилем и является селективным обратным агонистом к серотониновому рецептору 5HT2c. Таким образом, атомарные структуры 5HT2c, полученные в комплексах с эрготамином и ритансерином, позволяют не только понять, как отличаются активное и неактивное состояния рецептора (что само по себе является высоким достижением), но и установить причины селективности этих молекул».
Сравнение селективности исследованных препаратов эрготамина и ритансерина. Важнейшее отличие между ними — профиль селективности, то есть набор белков организма, с которыми они могут взаимодействовать. Ритансерин — крайне селективный препарат, действующий лишь на определённые подтипы серотонинового рецептора (тёмно синий-круг с жёлтыми кружками). Эрготамин же воздействует не только на все мишени ритансерина (голубой круг, в который входит и тёмно-синий), но и более чем на 800 других белков организма, вызывая множество разноплановых эффектов.
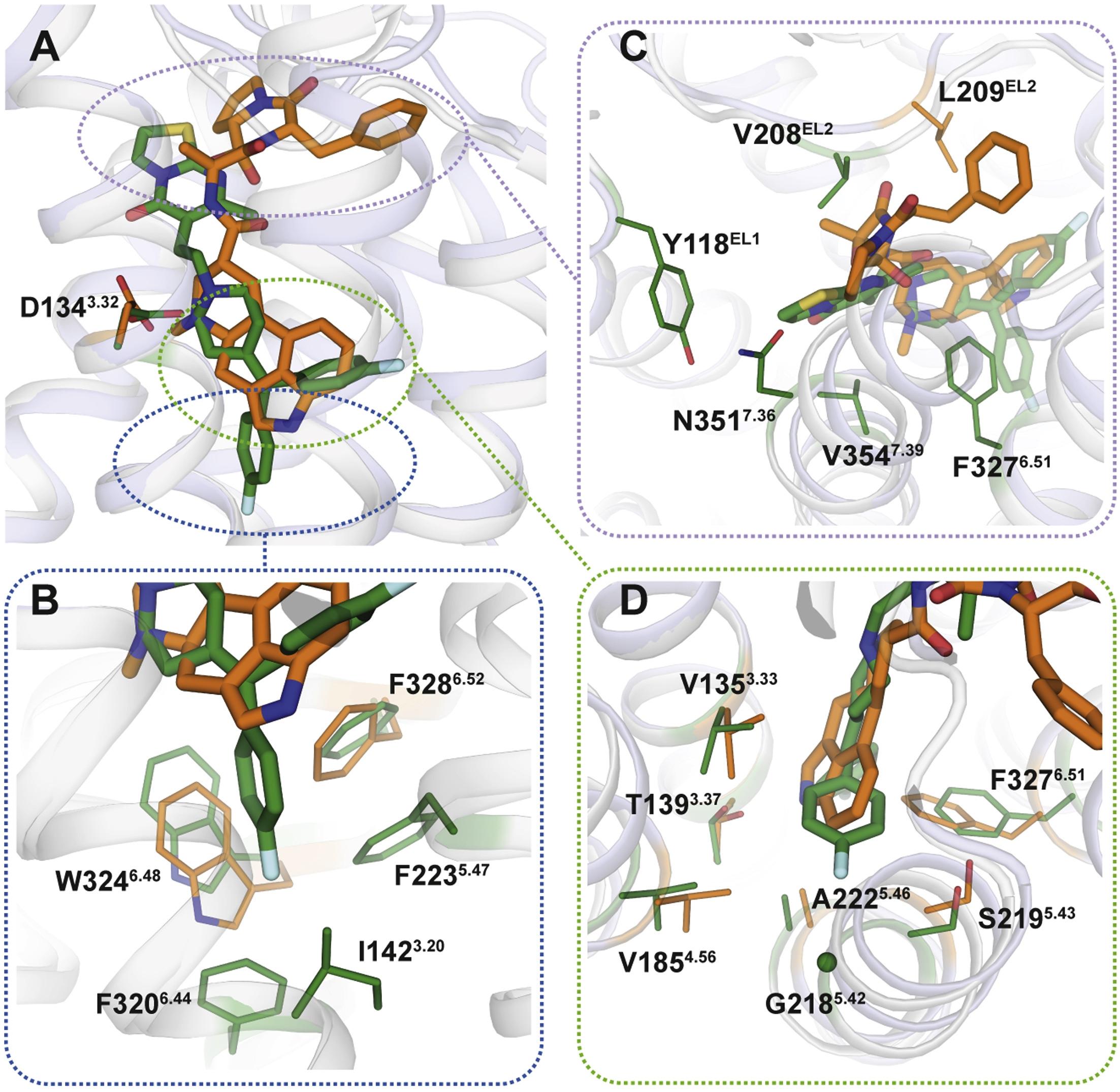
Методом рентгеновской кристаллографии исследователи получили 3D-модель белка в момент взаимодействия с препаратом. Как и ожидалось, связывание препаратов с рецептором происходит по-разному. Область, с которой связывается эрготамин, устроена очень похоже у многих белков, что обеспечивает его неселективность. Ритансерин же связывается с рецептором несколько иначе и взаимодействует с определёнными фрагментами, уникальными для той небольшой группы белков, на которые он действует. Учёные подтвердили, что именно эти участки белка отвечают за селективность, внеся в ген рецептора 5HT2c несколько мутаций, изменяющих эти фрагменты. Во всех случаях это приводило к снижению силы взаимодействия с ритансерином.
Пётр Попов, сотрудник лаборатории структурной биологии рецепторов, сопряжённых с G-белком, МФТИ рассказывает:
«Основная трудность в определении структуры данных рецепторов состояла в получении стабильной генно-инженерной конструкции, которая пригодна для кристаллизации и дальнейшего изучения. С помощью биоинформационного подхода с использованием методов машинного обучения мы определили стабилизирующие точечные мутации для рецептора 5HT2c как в активном, так и в неактивном состоянии».
Лекарственные препараты по-разному прикрепляются к белкам. Рентгенограммы комплексов белка с лекарственными препаратами, полученные исследователями, позволили изучить различия в способе закрепления молекулы лекарства на поверхности белка. Как можно видеть, эрготамин (оранжевая молекула) располагается на поверхности белка совершенно иначе, нежели ритансерин (зелёная молекула). К тому же они взаимодействуют с разными аминокислотами в молекуле мишени, чем и объясняется большая селективность ритансерина в сравнении с эрготамином.
Таким образом, анализ структурных особенностей белка в комплексе с препаратами разной селективности показал свою эффективность: с его помощью мы сможем управлять набором мишеней, а значит, прямым и побочным действием препаратов на этапе разработки. Благодаря этому пациенты смогут получать более эффективную терапию для многих заболеваний с меньшими побочными эффектами.
Текст: пресс-служба МФТИ