Фетальный алкогольный синдром представляет собой совокупность физических и психических дефектов, с которыми рождается ребенок, подвергшийся воздействию этилового спирта во время вынашивания.
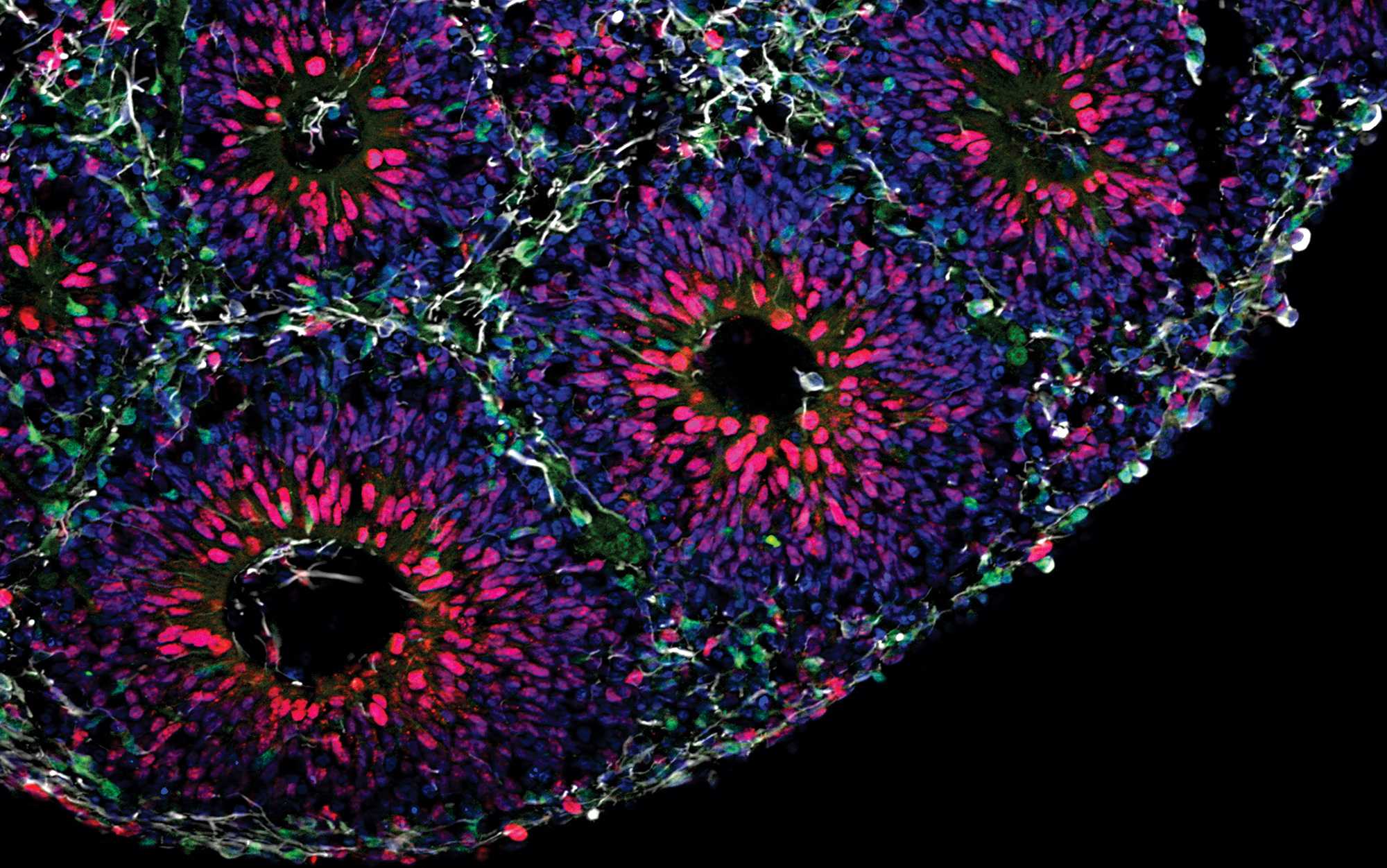
В новой работе, опубликованной в Molecular Psychiatry, исследователи показывают, как этиловый спирт нарушает деятельность и развитие нервной системы на молекулярном уровне.
Фетальный алкогольный синдром (ФАС) – одна из главных причин нарушения психического развития ребенка. Первичные когнитивные и поведенческие нарушения могут приводить к вторичной инвалидности: у ребенка возникают проблемы с психическим здоровьем, учебой, обнаруживаются сексуально-девиантное и зависимое поведение. И хотя клинические симптомы довольно четко задокументированы, все же не до конца понятно, какие процессы, происходящие в головном мозге под влиянием этилового спирта, приводят к подобным нарушениям.
В поисках ответа на этот вопрос исследователи из Медицинской школы Калифорнийского университета в Сан-Диего (США) использовали органоиды мозга (мини-брейны), выращенные из человеческих плюрипотентных стволовых клеток. Именно эти структуры ныне считаются лучшей основой для моделирования развития реального головного мозга.
Исследователи подвергали мини-брейны воздействию этилового спирта и всесторонне анализировали его влияние на развитие модели: пролиферацию нейронов и их жизнеспособность, изменение хроматина, модификацию гистонов, транскриптомные и протеомные сдвиги, электрофизиологию нейронов и формирование нейронных сетей.
Воздействие этанола приводит к микроцефалии
На всех стадиях развития головного мозга попадание в среду роста эмбриона этилового спирта приводит к развитию микроцефалии – недоразвитости черепа и головного мозга при нормальных размерах остальных частей тела. Магнитно-резонансная томография (МРТ) пациентов с ФАС также выявляет уменьшение площади и толщины коры, мозолистого тела, мозжечка и других подкорковых структур. Авторы исследования показали, что размер мини-брейнов в экспериментальных условиях действительно уменьшался по сравнению с теми образцами, которые не подвергались воздействию этанола.
Этанол нарушает транскрипцию генов
ДНК в клетке хранится в довольно компактной форме, называемой хроматином. Она сворачивается и плотно упаковывается за счет специальных белков – гистонов. Однако для того, чтобы синтезировать необходимые белки на основе информации, хранящейся в ДНК, клетке необходимо на некоторое время распускать эту структуру и открывать участки ДНК для транскриптомного аппарата – комплекса молекул, считывающих информацию с ДНК и переводящих ее в РНК, по которой затем выстраивается белок.
Методом полногеномного оценивания степени открытости хроматина (ATAC-seq) исследователи показали, что воздействие этанола делает множество участков хроматина недоступными для компонентов аппарата транскрипции. Причем это происходит в участках, где находятся гены, связанные с развитием нервной системы, нейрогенезом, нейротрансмиссией и межклеточными взаимодействиями.
Воздействие этанола привело к формированию уникального профиля модификаций гистонов. Он изменил модели метилирования гистонов и ацетилирования в различных типах нервных клеток. Метилирование ДНК и модификации гистонов регулируют доступность ДНК для транскрипционных белков и считаются центральными причинами пожизненных клинических эффектов ФАС.
Из-за этанола также блокируется передача сигналов через семейство сигнальных белков Rho GTPase, которые связаны с экспрессией генов, межклеточными взаимодействиями, морфологией нейронов и развитием клеточного цикла. Они вносят вклад в регуляцию выживания нейронов посредством активации пути MAPK, контролирующего множество важных процессов в клетке, такие как транскрипция генов, размножение клеток, запрограммированная клеточная смерть и другие.
Кроме того, из-за этанола блокируются участки хроматина, где располагаются гены, кодирующие нейрексины – белки, участвующие в раннем кортикальном построении синапсов (синаптогенезе), ведении аксонов и межклеточной коммуникации.
Авторы работы также отмечают, что воздействие этанола повлияло на многие белки, которые важны при других неврологических заболеваниях, включая воспалительные и дегенеративные белки.
Этанол разрушает астроциты
Помимо влияния на нейроны ФАС может также вызывать деформации в развитии нервной системы из-за разрушения астроцитов. Исследователи показали, что этанол увеличивает гибель астроцитов, вызывает сдвиги в их клеточном цикле и пролиферации.
Но кроме этого исследователи отметили увеличение количества астроцитарного белка GFAP в мини-брейнах под воздействием этанола. Этот белок участвует в коммуникации между нейронами и астроцитами, функционировании гематоэнцефалического барьера, восстановлении после повреждения ЦНС.
На основании полученных результатов авторы полагают, что роль астроцитов в патогенезе ФАС может быть более значительной, чем предполагалось ранее. Однако это предположение требует дальнейших более глубоких исследований.
Воздействие этанола приводит к нарушению целостности нейронных сетей
При электрофизиологическом анализе схемы нейронной сети с помощью многоэлектродной матрицы исследователи установили, что воздействие этанола вызвало нарушение синаптогенеза и снизило сетевое взаимодействие в органоидах. Причем эти изменения сети сохранялись в течение нескольких месяцев несмотря на прекращение воздействия. Это может говорить о том, что даже однократного воздействия этанола достаточно, чтобы вызвать длительные эффекты развития нервной системы.
Таким образом, авторы, используя современный метод изучения нервной системы – создание мини-брейнов, – показали, как воздействие этанола на молекулярном уровне нарушает рост и жизнеспособность клеток, меняет их эпигеномные и транскриптомные профили в областях, важных для развития нервной системы, вызывает дисфункции в формировании нейронной сети, нарушает несколько важных путей роста и передачи сигналов.
Будущие исследования, по предположению ученых, смогут обнаружить новые мишени для терапевтического предотвращения нейропатологии развития ФАС. Также хорошей новостью становится то, что некоторые из этих изменений удалось устранить с помощью специальных экспериментальных препаратов.
Текст: Анна Удоратина