Появление амилоидных бляшек в головном мозге долгое время считалось единственным объяснением развития болезни Альцгеймера.
Не так давно мы рассказывали вам об исследовании, в котором ученые из Университета Калифорнии установили, что при болезни происходит накопление в нейронах тау-белка. Казалось бы, амилоидная теория окончательно ушла в прошлое, но британские исследователи смогли установить связь между накоплением бета-амилоида снаружи от нейронов и агрегацией тау-белка внутри. Посредником оказался рецептор к норадреналину. Работа опубликована в журнале Science Translational Medicine.
Итак, два фактора, сопровождающие развитие болезни Альцгеймера – это бета-амилоид снаружи нейронов и тау-белок внутри них. Эти молекулы образуют вне- и внутриклеточные агрегаты и приводят к гибели нейронов. Однако то, каким образом они взаимодействуют между собой, до сих пор было неясно. Группа исследователей из Университета Алабамы в Бирмингеме, Великобритания, установила, что посредником между этими двумя белками служит рецептор к норадреналину.
Ученые обнаружили, что в мозге людей, умерших от болезни Альцгеймера, на клетках норадренергических нейронов, которые погибают еще на первых стадиях развития болезни, намного активнее работают α2A-адренорецепторы. Для подтверждения этих наблюдений провели ряд исследований на лабораторных мышах. Несмотря на то что мыши болезнью Альцгеймера не страдают, у них можно спровоцировать накопление бета-амилоида в нервной ткани, что приводит к развитию болезни с похожими симптомами. В ходе эксперимента установили, что у таких животных также наблюдалась более активная работа α2A-адренорецепторов. При этом количество самих рецепторов не увеличивалось.
Предположив, что бета-амилоид каким-то образом воздействует на эти рецепторы, исследователи пометили обе молекулы флуоресцентным маркером и установили, что бета-амилоид действительно концентрируется на поверхности клетки рядом с α2A-адренорецептором, при этом игнорируя другие виды адренорецепторов. Чтобы выяснить, какой именно сигнал бета-амилоид передает внутрь клеток, ученые изменили активность различных киназ (внутриклеточных ферментов). Интенсивнее всего, как оказалось, работала киназа GSK3.
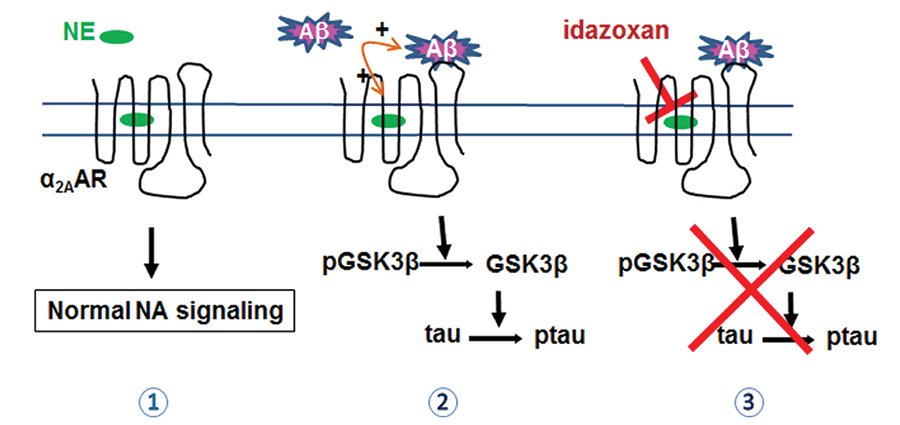
В результате исследователи предложили следующую цепочку взаимодействий: бета-амилоид соединяется с α2A-адренорецептором, далее происходит активация киназы GSK3, которая инициирует фосфорилирование (присоединение остатка фосфорной кислоты) тау-белка, и он, в свою очередь, впоследствии агрегируется с образованием внутриклеточных комплексов.
Эта связь между двумя звеньями патогенеза болезни Альцгеймера может произвести революцию в патофизиологии, которую уже давно ждут, и стать ключом для разработки будущего препарата, которым можно будет лечить и, возможно, вылечивать заболевание.
Текст: Мария Гоглова
