Дефицит натрия увеличивает выработку гормонов ангиотензина-II и альдостерона, которые заставляют нас потреблять продукты, содержащие соль.
Чтобы сигнал прошел успешно, необходимо совместное действие ангиотензина и чувствительных к альдостерону нейронов NTSHSD2, подробную схему работы которых изучили американские ученые из Медицинского центра Бет-Изрэйел. Работа опубликована в журнале Neuron.
Падение уровня натрия в крови приводит к снижению уровня плазмы крови и к гиповолемии, поэтому организму важно, чтобы сигнал о нехватке соли был четким и своевременным. Известно, что совместная работа двух гормонов, ангиотензина-II (ATII) и альдостерона, приводит к лучшему синергетическому эффекту, стимулируя экономное расходование натрия почками. Сигнал голода, который провоцирует альдостерон, опирается на работу чувствительных к этому гормону нейронов в ядре солитарного тракта, отмеченных экспрессией 11-бета-гидроксистероиддегидрогеназа, NTSHSD2. Клеточный механизм, с помощью которого NTSHSD2 нейроны становится активным во время дефицита натрия, в настоящее время не был известен. Не был известен и механизм, по которому действует ангиотензин-II.
Авторы новой работы решили изучить эти процессы, чтобы понять механизм активации нейронов NTSHSD2 недостатком натрия и роль этих нейронов в регуляции «солевого аппетита», а также выяснить, провоцирует ли совместное действие гормонов синергетический эффект в этих нейронах. Для этого ученые провели ряд экспериментов на мышах с генетическими мутациями и исследовали электрофизиологию среза мозга.
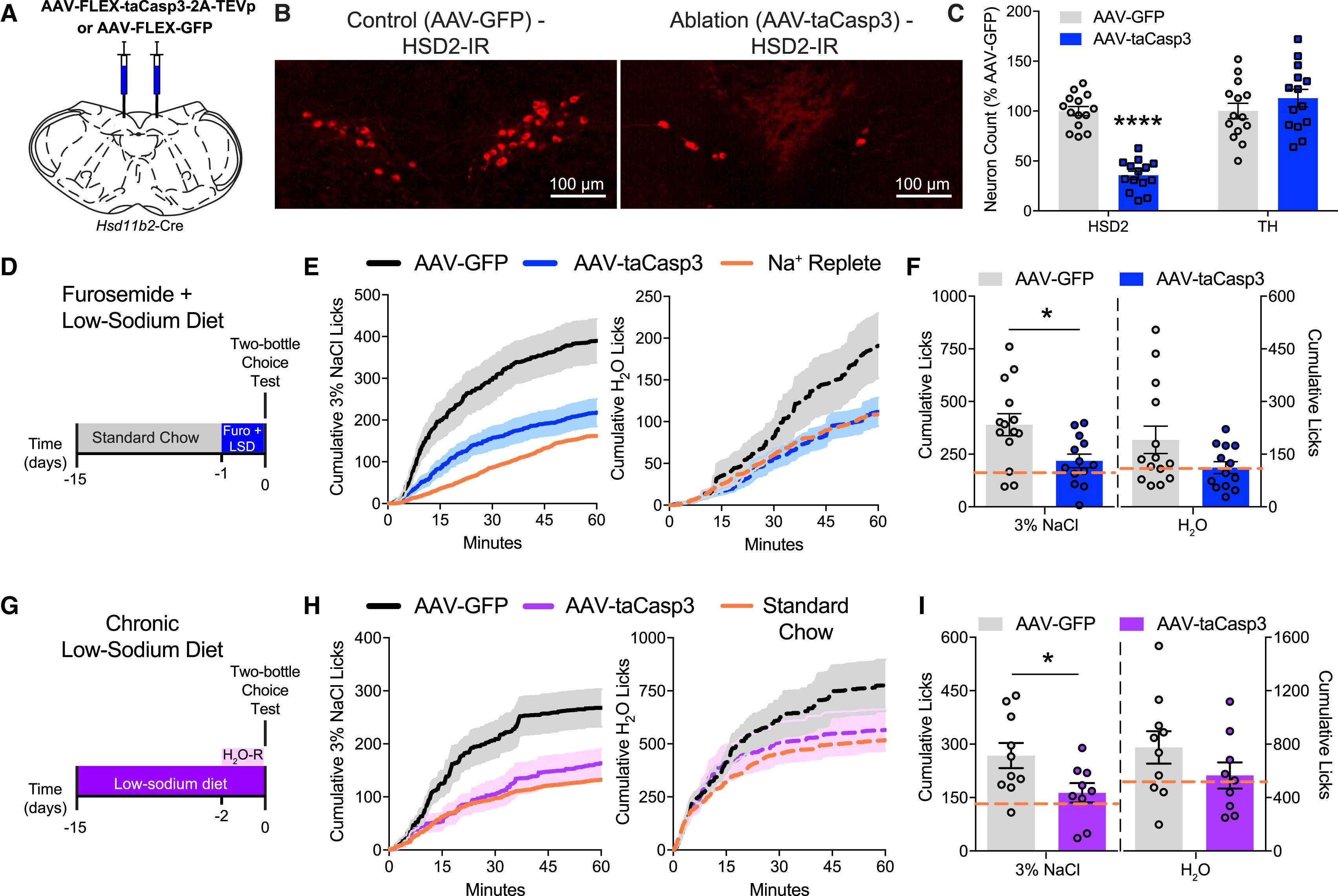
Диета с низким содержанием натрия спровоцировала нейронную активность и повысила аппетит у здоровых мышей. В условиях обычной диеты применение диуретика повысило потребление соленой воды у здоровых мышей, тогда как мыши, у которых отсутствовало около 65 процентов нейронов NTSHSD2, восполняли жидкость обычной водой, не проявляя интереса к соли. Впрочем, обычной воды они тоже пили немного меньше, чем их здоровые коллеги. Хроническая диета с низким содержанием натрия сама по себе не увеличила потребление соленой воды, и только в результате дополнительного ограничения на доступ к воде (и дальнейшего усиления гиповолемии) потребление соленой воды увеличилось в здоровой группе (p < 0,05), но осталось неизменным в группе с отсутствующими нейронами.
Абляция нейронов NTSHSD2 ухудшает солевой аппетит. B. Наличие NTSHSD2 у мышей после соответствующих инъекций. Слева — здоровая, контрольная группа, справа — группа со сниженным числом нейронов. C. Число нейронов (ось y, в процентах к среднему значению по контрольной группе). Слева по оси x — нейроны NTSHSD2, справа — нейроны, чувствительные к тирозингидроксилазе. E. Кумулятивное потребление соленой воды (слева, ось y) и обычной воды (справа, ось y) по минутам (ось x). Черный график — контрольная группа, синий — экспериментальная, оранжевый — группа с нормальным содержанием натрия (обычная диета) после приема диуретика. F. Те же результаты, что и в (E), потребление соленой воды (слева) и обычной воды (справа) за 60 минут. Серым цветом — контрольная группа, синим — группа со сниженным числом нейронов NTSHSD2.
Эти результаты свидетельствуют о необходимой роли нейронов NTSHSD2 в регуляции аппетита в ответ на понижение уровня натрия.
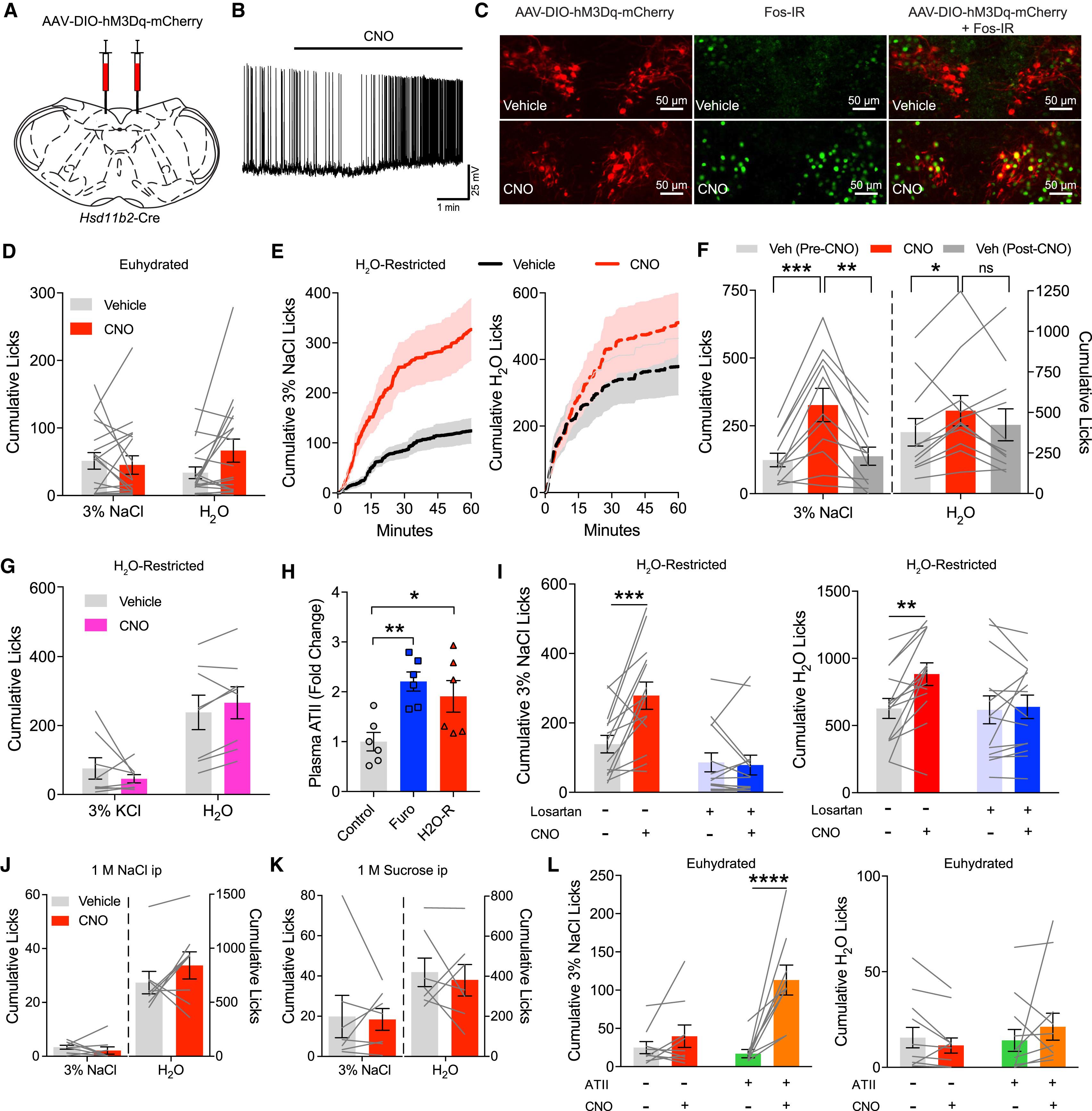
Далее ученые использовали химически модифицированные молекулы, чтобы искусственно активировать нейроны NTSHSD2. У мышей с высоким уровнем натрия активация не привела к повышенному потреблению соли.
Таким образом, дефицит соли повысил уровень альдостерона, который активировал нейроны NTSHSD2, но ответ организма оказался слабым: потребление увеличилось незначительно. Ученые предположили, что если вместе со стимуляцией нейронов подключить ангиотензин-II (повысить его уровень естественным образом), то удастся быстро спровоцировать солевой аппетит. Сниженное потребление воды приводит к увеличению ATII в плазме, и хотя жажда у мышей увеличивается, интерес к соли — нет (p = 0,12). Но вместе с искусственной стимуляцией нейронов NTSHSD2 потребление соленой воды увеличилось значительно (p < 0.001).
Как и применение диуретика, ограничение на потребление воды позволило увеличить уровень ATII. Но жажду можно спровоцировать и без увеличения ATII, если вколоть животному сахарозу или хлорид натрия.
Такая жажда (в отличие от жажды, спровоцированной ограничением на питье) не привела к значительным изменениям в потреблении обычной, сладкой или соленой воды. Жажда, вызванная ограничением на потребление обычной воды, вместе с искусственной стимуляцией нейронов привела к увеличенному потреблению соленой воды. Но самые значимые изменения произошли, когда экспериментаторы стимулировали нейроны и искусственно повысили уровень ATII: потребление соленой воды увеличилось значительно (p < 0,0001).
Стимуляция нейронов NTSHSD2 синергизирует с увеличением ангиотензина II и стимулирует потребление натрия. D-F: оранжевым цветом указаны результаты после стимуляции нейронов, серым — без стимуляции. По оси y — потребление жидкости. Слева — потребление подсоленной воды (3% NaCl), справа — обычная вода (H2O). D. Мыши с нормальным содержанием воды в организме (без дегидратации) через 60 минут после стимуляции нейронов. E. Мыши с ограничением на воду и дегидратацией. F. Светло-серым цветом указаны результаты до активации нейронов, темно-серым — после. J-L: ярко-оранжевым цветом показаны результаты после стимуляции нейронов, серым — без стимуляции, зеленым — только ATII, оранжевым — ATII и стимуляция (см. L, обозначения под графиками). По оси y — потребление соленой (слева) и обычной (справа) воды. J. Жажда вызвана подсоленной водой. K. Жажда вызвана подслащенной водой. L. Без жажды. Звездочками помечены значимые результаты.
Результаты демонстрируют необходимость участия альдостероночувствительных нейронов в ядре солитарного тракта в стимуляции аппетита на соленое, также как и недостаточность этих нейронов. Вместе с участием ангиотензина-II реакция на понижение уровня соли оказалась наиболее эффективной, даже без дополнительного ограничения на прием воды. Ученые отмечают необходимость дальнейших исследований, в частности, чтобы изучить механизм работы ангиотензина-II в возникновении солевого аппетита.
Ранее мы писали о подобной работе, которую ученые проделали в поисках «нейронов жажды», а также описывали механизм контроля аппетита и механизм возникновения чувства голода после принятия алкоголя.
Автор: Анна Зинина