Стареющий головной мозг людей с болезнями Альцгеймера и Паркинсона, а также другими нейродегенеративными заболеваниями изобилует характерными скоплениями белков в нейронах или вокруг них.
Как белковые сгустки могут вредить нейронам, до сих пор в большинстве случаев неясно, но эти сгустки являются отличительными признаками указанных заболеваний — и до сих пор они ассоциировались почти исключительно с состарившимся головным мозгом. Однако результаты недавнего исследования, проведённого группой учёных Стэнфордского университета (Stanford University), говорят о том, что, по-видимому, агрегация белков в стареющих клетках — универсальный феномен и что её можно наблюдать при большем количестве болезней старения, чем принято считать. Данное открытие требует по-новому взглянуть на негативные процессы, происходящие в клетках по мере того, как они стареют, и, возможно, указывает на новые способы предотвращения некоторых нежелательных последствий процесса старения.
«Это широко распространённое явление — не одна-единственная конкретная ткань, а множество различных тканей», — говорит не участвовавшая в данном исследовании Делла Дэвид (Della David), специалистка по процессам старения из Института Бабрэма (Babraham Institute) в Кембридже, Англия.
Кроме того, согласно данному исследованию, агрегация белков тесно связана с основными механизмами, благодаря которым клетки чрезвычайно деликатно регулируют свои физиологические свойства. Биологам необходимо будет тщательно выяснить, — возможно, для каждого конкретного случая, — что представляют белковые скопления — угрозу для клеток или созданную ими защиту.
Статья с результатами данного исследования, опубликованная в марте на сервере препринтов biorxiv.org, представляет собой первую попытку количественно оценить степень агрегации белков во всём организме во время естественного старения позвоночного животного — в данном случае рыбы с очень короткой продолжительностью жизни. Исследование показало, что, вероятно, агрегация белков с течением времени способствует постепенному ухудшению состояния многих тканей. Опираясь на полученные результаты, можно даже предположить, по какой причине эти скопления гораздо более заметны в головном мозге, чем в других тканях: возможно, это связано с его более быстрым развитием.
Дэн Ярош (Dan Jarosz), системный биолог из Стэнфорда, наблюдавший за ходом этих экспериментов вместе со своей коллегой-генетиком Анной Брюне (Anne Brunet), не ожидал, что так много белков скапливается в стареющей рыбе — и что очень часто эти же самые белки в мутантных формах связаны с дегенеративными заболеваниями. «Это заставило меня задуматься, не происходит ли агрегация белков при многих других возрастных заболеваниях, которые ныне не связывают с ней», — сказал он.
Подсказки от рыбы
Африканский нотобранх Фурцера (Nothobranchius furzeri) обитает во временных прудах Восточной Африки, образующихся во время сезона дождей. По мере того, как эта рыба приближается к концу своей 4—6-месячной жизни, у неё развивается целый ряд возрастных заболеваний, включая катаракту и изменения, связанные с мозгом, которые напоминают такое человеческое нейродегенеративное расстройство, как болезнь Альцгеймера. Короткая продолжительность жизни нотобранха — гораздо более короткая, например, чем лабораторной мыши, — и быстрое естественное старение делают его идеальной моделью для изучения старения позвоночных.
«Что поражает в этой рыбе, так это то, что при её старении имеют место не только агрегация белков, сердечная недостаточность или дисфункция головного мозга, — говорит специалист по процессам старения, биолог-эволюционист Дарио Валенцано (Dario Valenzano) из Института Макса Планка (Max Planck Institute) и Института Лейбница (Leibniz Institute), Германия, который проходил постдокторантуру вместе с Брюне. — Практически любой орган и любая ткань, которые мы наблюдаем, претерпевают некоторые прямо-таки катастрофические преобразования во время старения».

Команда из Стэнфорда провела обширный анализ белков нотобранха на различных стадиях его молодости и зрелости. У стареющего нотобранха учёные обнаружили белковые скопления во всех тканях, которые они исследовали: не только в головном мозге, но также в сердце, кишечнике, печени, мышцах, коже и семенниках. Более половины скапливающихся белков проявили в дальнейших экспериментах тенденцию к агрегации, имеющую, по всей видимости, врождённый характер.
Но то, какие именно белки слипались, образуя скопления, в разных тканях оказалось существенно разным. В нескольких тканях экспрессия многих белков происходила, в сущности, на эквивалентных уровнях, но, если в одних тканях белки скапливались, то в других никакого белкового слипания не происходило.
«Степень тканевой специфичности скапливающегося протеома поражает», — говорит Дэвид. Она и другие исследователи считают, что в основе этих различий лежит то, как клетки поддерживают качество своих белков. Клетки имеют сложный механизм контроля за правильным сворачиванием длинных цепочечных пептидных молекул, из которых состоят белки, и даже контроля за тем, чтобы в конечном итоге эти цепочки распадались для рециркуляции. Однако, отмечает Ярош, ткани могут по-разному зависеть от различных аспектов процесса контроля качества белков, и с возрастом эти акценты могут меняться.
«Это очень важная тема, ибо причина, по которой в разных тканях нейродегенеративные заболевания проявляют себя весьма специфично, — огромное белое пятно в биологии человека», — говорит не участвовавшая в исследовании Стэнфордского университета Синтия Кеньон (Cynthia Kenyon), вице-президент биотехнологической компании Calico Life Sciences по изучению старения. И в самом деле: никто не знает, например, почему амилоидные белковые бляшки при болезни Альцгеймера образуются в гиппокампе головного мозга, а белковые скопления при болезни Паркинсона специфичны для дофаминовых нейронов. Возможно, что различные клетки по-разному поддерживают качество своих белков. Это, считает Кеньон, «по меньшей мере, весьма правдоподобное объяснение того, почему разные ткани ведут себя весьма неодинаково».
Важность контроля качества
Исследования червей и мух убедительно показали, что при сбоях в работе механизма, который обеспечивает стабильность белков, животные стареют быстрее. При генетическом улучшении путей осуществления контроля за качеством белков животные, как правило, живут дольше. Всё это не означает, что агрегация белков вызывает старение, но явно говорит о тесной взаимосвязи этих явлений.
Чтобы продолжить изучение взаимосвязи между агрегацией белков и старением, исследователи из Стэнфорда более внимательно изучили белки мутантной разновидности нотобранха, которая стареет необычайно быстро. У этих рыб имеется мутация в гене теломеразы, следящей за сохранением длины делящихся хромосом; животные с мутациями теломеразы обычно быстро стареют.
По словам Яроша, он и его коллеги ожидали обнаружить в кишечнике и других быстрорастущих или быстро преобразующих себя тканях меньшее количество белковых скоплений, поскольку экстраординарное клеточное деление даёт таким тканям больше возможностей для удаления скоплений и восстановления самих себя. Но верно и обратное: такие ткани содержат больше неправильно свёрнутых и слипшихся белков и стареют быстрее, чем ткани, которые растут медленно.
Опять же, хорошим объяснением могут служить проблемы с клеточным контролем качества белков. Если клетки теряют контроль над процессами, которые поддерживают качество их белков, с каждым клеточным делением число повреждений, причиняемых белковыми скоплениями, может возрастать. Ткани, которые быстро растут, могут ускоренно стареть из-за того, что создают благоприятные условия для аккумуляции этого вреда.
Конденсация, агрегация и прионы
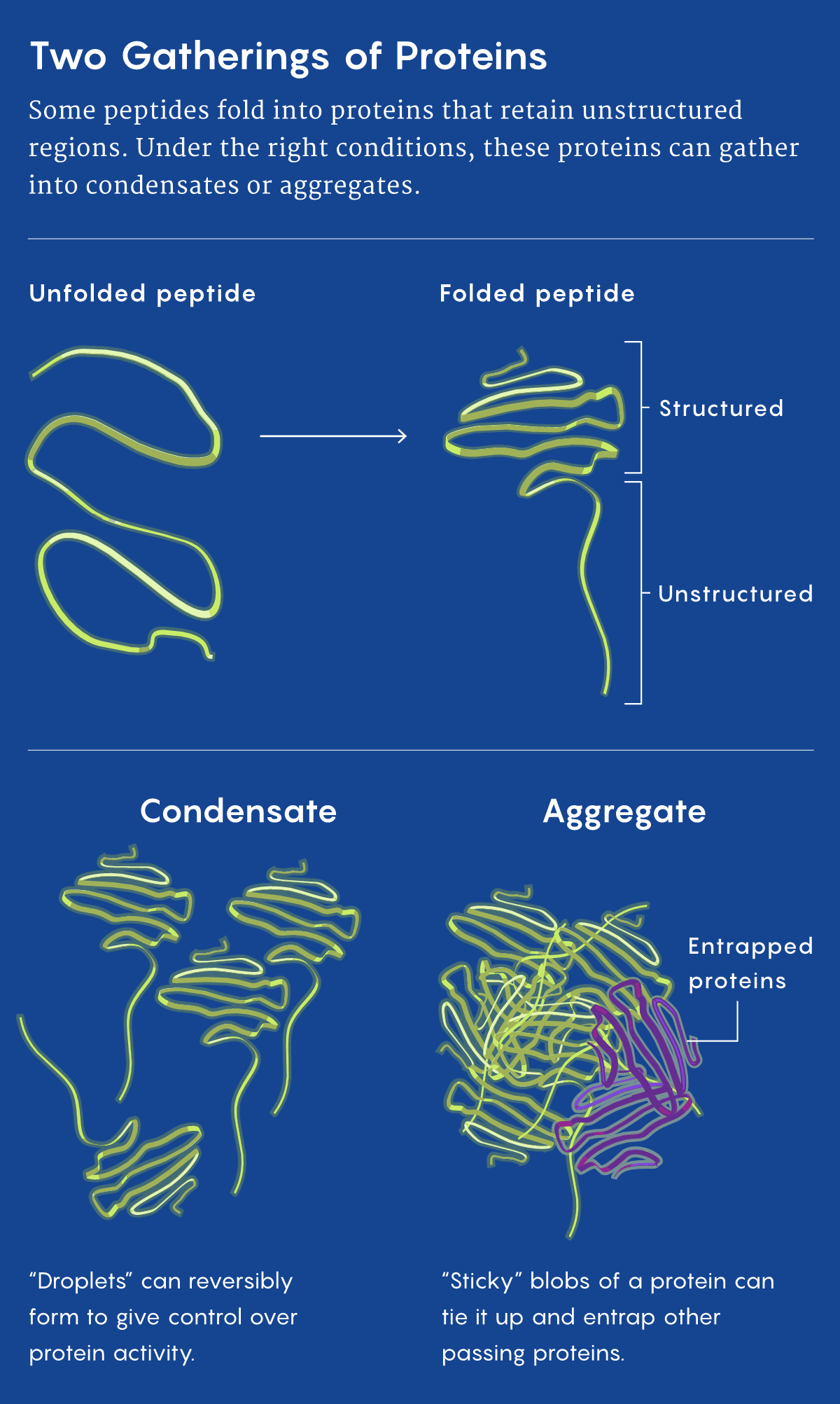
Почему белки иногда скапливаются, объяснить сложно. К удивлению учёных, оказалось, что частичное объяснение даёт конденсация — важный механизм клеточного контроля за белками.
Сложные трёхмерные формы, возникающие при сворачивании пептидов, исторически считались определяющими активность и функции входящих в эти структуры белков. Но примерно за последние десять лет было обнаружено, что растёт список белков, имеющих «внутренне неупорядоченную» область, которая не способна сворачиваться в стабильную форму. При правильных условиях множество этих белков собирается в капли, или конденсаты, — обратимый процесс, похожий на «разделение фаз», при котором в воде образуются масляные капли. Данный процесс может усиливать активность ферментов, концентрируя их вместе с их субстратами, или подавлять эту активность, изолируя ферменты от их субстратов. Клетки, изменяя внутри себя локальную концентрацию субстратов и ферментов, способны использовать конденсаты для точной настройки своей белковой активности.
Однако вдобавок белковые неупорядоченные области могут вести к более прочным скоплениям белков, сковывая работу клеток и нанося им ущерб. Хуже того, некоторые дефектные белки не только неправильно сворачиваются и образуют вредные скопления сами, но и вызывают неправильное сворачивание других белков того же типа, что приводит к цепной реакции вредного скапливания. Концептуально это похоже на то, что происходит при «коровьем бешенстве» и одном из вариантов синдрома Крейтцфельдта — Якоба, при котором аномально свёрнутые белки, называемые прионами, катализируют волну аномальной агрегации белков в головном мозге.
Таким образом, конденсация является механизмом контроля, который сопряжён с определёнными рисками. Но, с точки зрения эволюции, его преимущества, по-видимому, настолько существенны, что цена — уязвимость ко многим заболеваниям, связанным со старением, — по-видимому, стоит того, чтобы платить, отмечает Ярош.
Яркую иллюстрацию этому даёт второй препринт, опубликованный стэнфордской командой в марте. Здесь исследователи сосредоточились на белке под названием DDX5, который накапливается в стареющем мозге нотобранха. DDX5, наиболее активный в своём конденсированном состоянии, выполняет в организме много важных функций, нередко помогая ему установить, произведены ли другие белки надлежащим образом. Исходя из аминокислотной последовательности DDX5, учёные предсказали, что его поведение будет прионным, и в дальнейшем их прогноз подтвердился: один неправильно свёрнутый белок DDX5 способствует неправильному сворачиванию и агрегации других молекул DDX5.
Однако агрегация на этом не заканчивается: исследователи из Стэнфорда обнаружили в сгустках DDX5 и другие белки. Скопления могут временами действовать как «липкие сгустки», которые захватывают другие белки, хаотично вмешиваясь в клеточные функции, объяснил Джон Лаббадия (John Labbadia), чья лаборатория в Университетском колледже Лондона (University College London) изучает контроль качества белков и старение.
«Это говорит о том, что у нас есть … белки, которые с возрастом скапливаются и способны катализировать дальнейшую агрегацию белков прионоподобным образом, что ранее не фиксировалось», — сказал он.
Команда из Стэнфорда тщательно выявила ту область белка DDX5, благодаря которой конденсация контролирует его активность — и оказалось, что это — та же область, которая вдобавок делает его склонным к скапливанию. Контроль над естественной функцией белка и его склонностью к агрегации неразрывно связаны. «Это Уловка-22», — сказал Лаббадия.
«По-моему, — считает Ярош, — произошёл весьма интересный сдвиг в осмыслении данной темы: для деятельности, если брать её в очень узком смысле, неупорядоченный домен не требуется, но, с точки зрения действительного развёртывания этой деятельности в живой системе, оказалось, что он, на самом деле, играет чрезвычайно важную роль».
Патология или защита?
Что именно вызывает образование скоплений и насколько они вредны для клеток, остаётся, как отмечает Кеньон, «тяжёлой, фантастической, огромной проблемой в данной сфере исследований». С одной стороны, скопления связывают DDX5 и другие белки, эффективно препятствуя осуществлению важных клеточных функций. Но, кроме этого, скопления способны и помогать клеткам выживать, оказывая защитный эффект.
Хорошим примером защитного эффекта стали исследования хантингтина — белка, в наибольшей степени представленного в головном мозге. Хантингтин необходим для здорового развития нервной системы, но у людей с болезнью Хантингтона мутация этого белка приводит к тому, что он становится ненормально длинным. Затем этот длинный белок распадается на короткие токсичные сегменты, которые причиняют нервной системе вред.
В 2004 году Стив Финкбайнер (Steve Finkbeiner), исследователь старения в Институтах Гладстона (Gladstone Institutes) и Калифорнийском университете в Сан-Франциско (University of California, San Francisco), изучал агрегацию белка хантингтина в культивируемых нейронах. Его команда показала, что, хотя все нейроны, экспрессирующие аномальный белок хантингтин, со временем умирают, нейроны, которые имеют скопления хантингтина, живут дольше, чем те, которые их не имеют.
«Это было первое доказательство того, что образование [скоплений] — защитная реакция на другие субмикроскопические формы неправильно свёрнутых белков, вызывающие проблемы», — объяснил Финкбайнер редакции Quanta magazine в электронном письме.
С тех пор он и другие учёные показали, что защитная реакция скапливания возникает и при других нейродегенеративных заболеваниях. По мнению Финкбайнера, это может объяснить, почему попытки лечить болезнь Альцгеймера путём нацеливания на бляшки оказались неудачными: если характерные для этой болезни амилоидные бляшки формируются для защитного связывания дефектного белка, то разрушение бляшек может принести больше вреда, чем пользы.
«Людям трудно понять эту концепцию, поскольку здравый смысл говорит, что вещи, которые выглядят ненормально, должны быть «плохими» и патогенными, — написал Финкбайнер. — Но биология сложна, в ней множество петель обратной связи, поэтому, чтобы не попасть впросак, важно не делать поспешных выводов».
Универсальная проблема со множеством решений
Вот картина, которая ясно вырисовывается в настоящее время: агрегация белков — это явление, не ограниченное нейродегенеративными заболеваниями. Это часть жизни любой клетки, способной состариться. Многие нормальные, важные для развития белки, такие как DDX5, имеют тенденцию к агрегации, и борьба с этим слипанием является универсальной задачей, стоящей перед всеми клетками.
Поскольку эта клеточная проблема — очень давняя, возможно, что предотвращение агрегации выступало как главная движущая сила эволюции белковых последовательностей. Так как обильно представленные белки склонны к агрегации, а мутации усиливают эту тенденцию, естественный антимутационный отбор в изобилующих белках, вероятно, совершается очень жёстко. (Это предположение подтверждается тем фактом, что у молодых животных обильно представленные белки, как правило, имеют более низкую частоту мутаций). Таким образом, дефицитные белки могут эволюционировать быстрее, чем изобилующие белки, и более высокая скорость эволюции должна коррелировать со склонностью к агрегации.
Брюне и Ярош заметили, что этот эффект очень ярко представлен в головном мозге нотобранха. Исследователи предположили, что скапливающиеся изобилующие белки имеют ключевое значение для инновационных сдвигов в этом органе. Если это так, то эволюционные изменения головного мозга, которые сделали его чрезвычайно важным органом позвоночных, возможно, сделали его и более уязвимым для дегенеративных заболеваний, вызываемых агрегацией.
И в самом деле: вполне вероятно, говорит Ярош, что каждая ткань и каждый орган должны найти свой баланс или компромисс между выполнением своей работы и управлением агрегацией белков. Для каждой ткани есть уникальные функциональные требования и ограничения, которым она должна подчиняться: клетки кишечника постоянно обновляются; эндокринные клетки вырабатывают и секретируют гормоны; иммунные клетки, обнаружив захватчиков, бросаются в бой; головной мозг обрабатывает информацию. Для разных работ требуются разные белки, а это значит, что эволюционно появившиеся стратегии борьбы с агрегацией белков не могли не варьировать от ткани к ткани и от животного к животному. Поскольку головной мозг позвоночных в относительно недавнем прошлом эволюционировал гораздо интенсивнее и быстрее, чем, скажем, мышцы, его механизм контроля качества белков, возможно, ещё не успел выработать адекватную защиту от агрегации относительно новых белков.
Тем не менее, фундаментальная проблема агрегации белков существует для всех организмов постоянно, а не только во время перерывов между болезнями и тяжёлыми стрессовыми состояниями. Прионоподобный DDX5 и схожие с ним белки, говорит Дэвид, «обладают врождённой склонностью к агрегации, и организм стремится защититься от неё. Это физиологическое явление, которое все мы должны учитывать».
И тот факт, что скапливание белков во всех органах является фактором старения таких разнородных организмов, как дрожжи, черви, мухи, рыбы, мыши и люди, добавила она, «означает, что биологи должны уделять этой теме гораздо больше внимания».
Автор: Вивьен Калье (Viviane Callier), Перевод: Александр Горлов