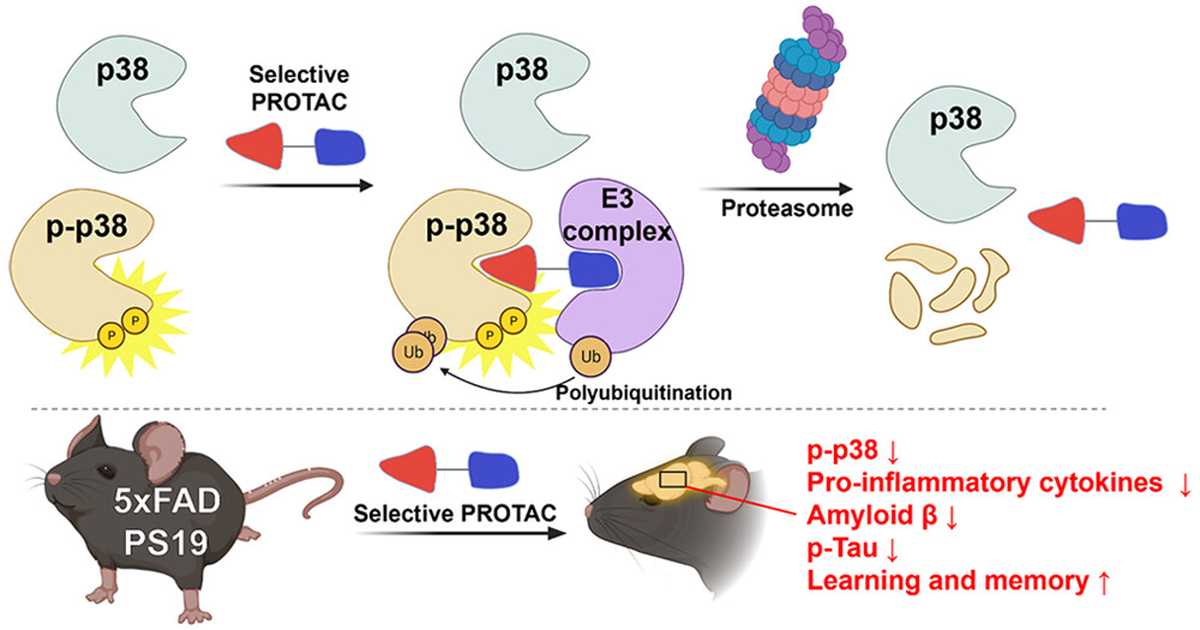
Введение в мозг мышам с болезнью Альцгеймера разрушителя фермента p38 митоген-активируемой протеинкиназы (p38 MAPK) PRZ18002 через нос приводит к значительному улучшению у них пространственного обучения и памяти.
К таким результатам приходят ученые в работе, опубликованной в журнале ACS Central Science. Также у мышей снижались уровни бета-амилоида, тау-белка и провоспалительных цитокинов в веществе головного мозга.
MAP-киназы участвуют во внутриклеточных сигнальных путях, регулируя ответ клетки на внеклеточные стимулы. Известно, что один из трех видов фермента – p38 MAPK – активируется провоспалительными цитокинами и запускает порочный круг хронического воспаления. Также его фосфорилированная форма (p-p38) в клетках головного мозга, по-видимому, частично ответственна за патогенез при болезни Альцгеймера: его ингибирование снижало воспалительную активность, накопление бета-амилоида и тау-белков. Однако исследования его ингибиторов фермента на мышах не показывали значимой эффективности и выявляли серьезные нежелательные реакции.
Поэтому Нам Чжон Ким (Nam-Jung Kim) с коллегами из Университета Кёнхи проверил на мышах зарекомендовавший себя метод целенаправленной деградации белков, когда специфические малые молекулы разрушают внутриклеточные белки, что вместе с нокдауном генов может улучшить эффективность лечения.
В своих предыдущих исследованиях ученые обнаружили молекулу PRZ-18002, которая активно потенцирует действие убиквитинлигазы – фермента, присоединяющего убиквитин к белку-мишени и таким образом разрушающего его. Примечательно, что эта молекула специфически разрушает только p38 и его фосфорилированную форму, никак не влияя на другие варианты фермента. Кроме того, активность молекулы находилась в прямой зависимости от активности экспрессии гена белка цереблона, который совместно в комплексе с E3 убиквитинлигазой отвечает за очистку клеток от отработанных структурных элементов и репарацию ДНК.
Для начала ученые проверили действие разрушителя в линиях человеческих клеток печени и микроглии и в нейробластах и клетках гиппокампа мышей. Во всех линиях PRZ-18002 дозозависимо снижал уровень p-p38, причем наиболее эффективно это происходил в клетках нервной ткани. Кроме того, после воздействия препарата в клетках значительно снизился уровень мРНК провоспалительных цитокинов при том, что уровень мРНК p38 никак не изменился. Контрольные молекулы никак не влияли на уровень экспрессии цитокинов.
Затем ученые через нос вводили лекарство в мозг мышам с моделью болезни Альцгеймера на протяжении восьми-девяти месяцев. Уже спустя месяц ученые наблюдали значительное уменьшение p-p38 в коре больших полушарий и гиппокампе. Спустя девять месяцев у мышей значительно улучшились результаты теста прохождения лабиринта, что свидетельствует об улучшении пространственной памяти и обучения.
Кроме того, PRZ-18002 достоверно снижал уровень бета-амилоида в коре головного мозга и гиппокампе мышей (p < 0,05). Также у мышей, которым вводили PRZ-18002, значительно снизился уровень мРНК провоспалительных цитокинов и фосфорилированного тау-белка. При этом у мышей не отмечали серьезных нежелательных реакций.
Таким образом, ученые проверили потенциально новый подход к лечению болезни Альцгеймера. Хотя пока исследование затронуло только мышей, его результаты способствуют увеличению интереса исследователей к изучению этого метода.
Автор: Слава Гоменюк