Новый механизм, останавливающий прогрессирование болезни Хантингтона, обнаружили ученые из UCL и Кембриджского университета в составе исследовательских групп в Британском научно-исследовательском институте деменции.

Оказалось, что один из белков «починки» ДНК может влиять и на считывание патологического нуклеотидного повтора, который характерен для заболевания. Это исследование, опубликованное в журнале Cell Reports, может помочь реализовать терапию этой редкой генетической патологии.
Болезнь Гентингтона – прогрессирующее генетическое нейродегенеративное заболевание, лечения которого на данный момент не существует. В Великобритании его частота составляет примерно 1 на 10000 человек. Наследственная мутация, вызывающая болезнь Гентингтона, хорошо известна – это совокупность многократно повторяющейся тройки нуклеотидов CAG в гене белка гентингтина (HTT), которая ведет к синтезц неправильного белка, «засоряющего» клетки.
Мы не раз публиковали материалы об экспериментальных предложениях по лечению этого заболевания, среди которых были и антисмысловые олигонуклеотиды, и перепрограммирование нервных клеток, и генетическая терапия. Тем не менее пока ни одно из них не прошло все стадии клинических испытаний и не было одобрено для клинического использования.
В нынешней работе ученые исследовали роль FAN1 — белка репарации ДНК, ген которого оказался модификатором болезни Гентингтона в нескольких генетических исследованиях. Однако механизм этого оставался непонятным до сих пор.
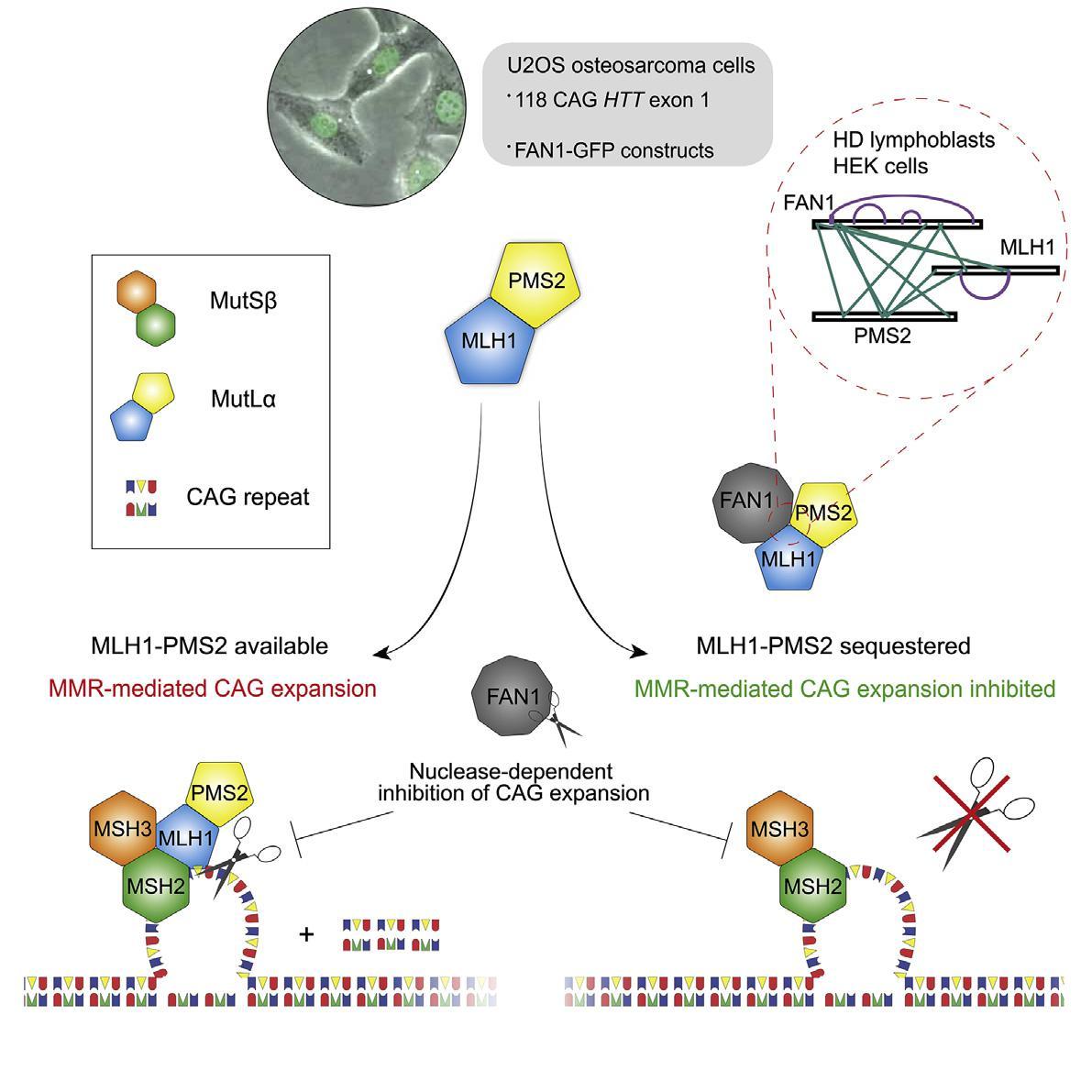
Выяснилось, что белок FAN1 может блокировать накопление факторов репарации ошибок спаривания нуклеотидов в ДНК. Делает он это с помощью специфических молекулярных механизмов при участии другого белка MLH1, который также участвует в восстановлении нормальной структуры ДНК. Связываясь с комплексом белков, в который входит MLH1, белок FAN1 способен останавливает «считывание» повторов, которые превращаются в патологические «хвосты» свежесинтезированного гентингтина. Таким образом белок гентингтин, синтезированный на «поломанном» гене, получается правильной конфигурации.
В будущем эта работа может помочь создавать лекарства, которые сымитируют или усилят мощность FAN1 в его возможности подавлять комплекс «репарации ошибок спаривания нуклеотидов» и изменят течение заболевания.
В настоящее время команда работает с биотехнологической компанией Adrestia Therapeutics, чтобы превратить эти открытия в работающие методы лечения для значительного числа пациентов в Великобритании и во всем мире.
Текст: Лена Моргун