Справиться с болезнью Паркинсона? Легко. Остановить болезнь Альцгеймера? Вопрос времени. Помочь людям с атаксией Фридрейха (наследственная патология)? Возможно…
На всё это организм способен сам, только нужно ему немного помочь, а именно – сделать липидные мембраны клеток устойчивыми к разрушительному действию свободных радикалов, которые «сжигают» их составные части – жирные кислоты – и обеспечивают клетки не только «дырами» в оболочке, но и токсичными продуктами «горения». Как это сделать – вопрос хороший, и биохимик русского происхождения и советской школы, а также основатель компании Retrotope (резидента Кремниевой долины) Михаил Щепинов cчитает, что нашёл на него ответ. О нём он рассказал студентам МГУ и всем желающим в рамках своей лекции, прошедшей 26 января 2017 года на факультете биоинженерии и бионформатики.
Обделённые вниманием
«Вот представьте, что вы идёте по современному городу, задираете голову, осматриваясь, а вокруг вас такие красивые сверкающие небоскрёбы, где работают крутые учёные, выигрывают мегагранты, летают бизнес-классом и вообще живут очень хорошо. А на небоскрёбах написано «ДНК-технологии». Идёте вы дальше, видите московские высотки, они уже пониже, постарше, чуть обшарпанее, и там тоже работают учёные, но выигрывают и гранты поменьше и живут не так роскошно. Это те, кто занимаются белками и аминокислотами. Ну и, наконец, заходите вы в какую-то подворотню, там грязно, неопрятно, что-то чавкает под ногами. Вот в таком состоянии на данный момент находится изучение липидов», — начал своё выступление Михаил.
И ведь на самом деле, мало кто сейчас, даже если взять мировую науку, всерьёз занимается липидами, а ведь это – чуть ли не самые многочисленные структурные элементы клеток. Абсолютно у всех живых организмов клеточная мембрана устроена сходным образом и состоит из липидного бислоя, который «оберегает» внутреннюю среду клетки от внешних «посягательств» и позволяет ей выжить. Мембраны внутриклеточных органелл также состоят из липидов.
Однако, подавляющее большинство учёных, в том числе в поисках «таблетки от всех болезней» и «эликсира вечной молодости» устремляет своё внимание на генетический код и в меньшей степени – на белки. Ищут ответы в процессах регенерации и репарации, обращаются к бактериальной системе редактирования генома CRISPR/Cas9, пытаются «омолодить» белки и совершенно забывают о липидах, а ведь именно их в огромных количествах «косит» совершенно неконтролируемый организмом процесс, который называется «перекисным окислением».
Дело в том, что до появления кислорода клеточный обмен веществ шёл крайне медленно, бактерии никуда «не торопились», и окисление, скажем, железа могло растягиваться на неопределённо долгий срок. Кислород же дал энергию гораздо большую, позволил полностью перестроить метаболизм, приобрести многоклеточность, более активную жизнь, определённую иерархию организмов, но вместе с этим «принёс» с собой и необратимые процессы старения и «износа». Собственно, в этом заключается парадокс: кислород несёт как жизнь, так и смерть. Почему же смерть?
«Сожжённые» заживо
В ходе клеточного дыхания, при котором происходит восстановление кислорода, нет-нет, да и появятся патологические вещества – свободные радикалы. За счёт своего химического строения они будут крайне активно реагировать с соседними молекулами и передавать им свою энергию. Проблема в том, что этому тоже будет способствовать кислород, которого в клетке много, и поэтому процесс приобретёт характер цепной реакции, которая, как можно вспомнить из курса физики в школе, самовоспроизводится и почти не контролируется. Конечно, в мембране клетки, как и в атомном реакторе, есть своеобразные «ограничители» — антиоксиданты – те вещества, которые нейтрализуют свободные радикалы, но их не так много (1 на 2000 липидных остатков), а расположены они на некотором расстоянии друг от друга. И пока «пожар» до них дойдёт, то «лес» из липидов, оказавшийся между «возгоранием» и «лесничеством» уже будет сожжён.
По словам Михаила, наиболее полезные для организма (и поэтому более многочисленные) полиненасыщенные жирные кислоты, у которых несколько двойных химических связей между молекулами углерода. Они то как раз активно вступают в контакт со свободными радикалами, потому что «слабых мест» между этими связями больше. Но так как именно такие кислоты придают мембранам необходимую текучесть (вспомните растительные и животные жиры: чем больше ненасыщенных жирных кислот, тем жиже масло), то организм с повышенным окислением вынужден мириться и тратить очень много энергии на то, чтобы восстановить мембранные бреши. Один только мозг, как известно, забирает 25% всех энергетических ресурсов и на целую одну четверть от этого заменяет дефектные липиды на здоровые.
Михаил отмечает, что очень многие заболевания имеют в своей основе окислительный стресс, начиная от атеросклероза и заканчивая болезнью Альцгеймера. Организм попросту не справляется с этими липидными разрушениями, и постепенно накапливаются последствия сбоев в обмене веществ, фатальные для клеток, а потом и для тканей и органов. И, конечно, нужно искать тот путь, который бы помог исправить ситуацию. Его-то учёный и нашёл.
Заменяй и властвуй
Необходимо было придумать что-то такое, что позволило бы «напичкать» молекулу липида «химией», не изменив её природные свойства и не получив отторжение организмом. Понимание пришло постепенно: дейтерий. Согласно концепции Михаила, можно заменить водород в нестабильных местах между двойными связями на его брата-близнеца – изотоп, который по химической структуре с ним полностью схож, но имеет ядро в два раза тяжелее. Они провели эксперименты на дрожжах с «отредактированными» линолевой (омега-3) и линоленовой (омега-6) жирными кислотами и были поражены увиденным эффектом.
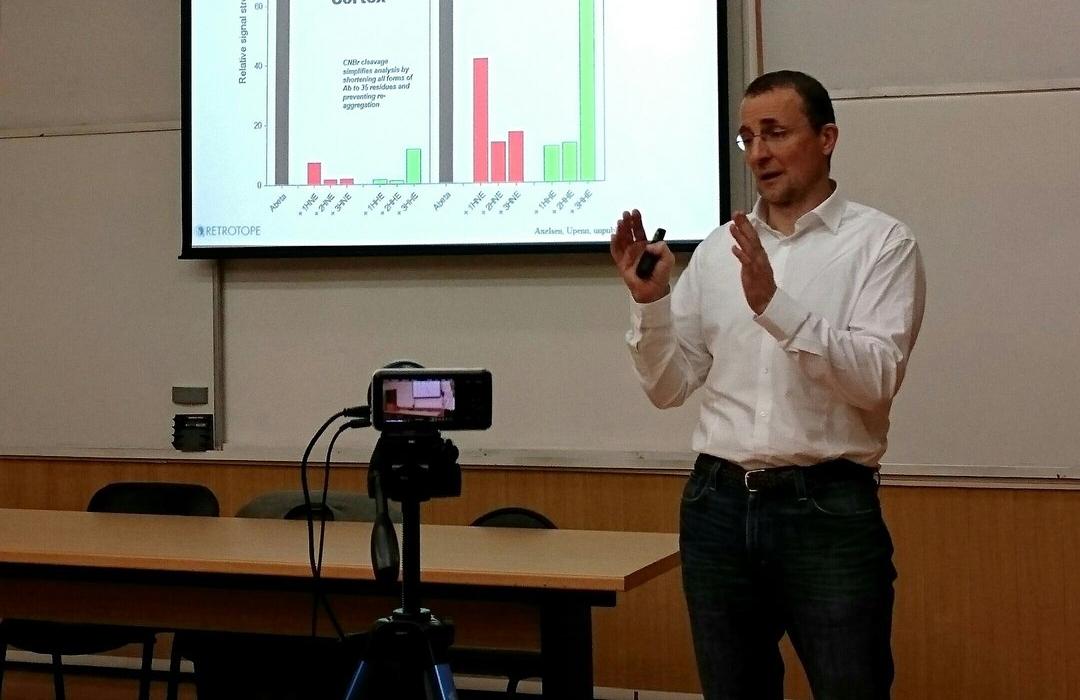
Суть эксперимента состояла в следующем: дрожжи помещались в среду с полиненасыщенными жирными кислотами, которые успешно «насасывали» внутрь. А поскольку сами они их не синтезируют, то и механизмов защиты – антиоксидантов – у них нет, соответственно, эти кислоты тут же начинали активно подвергаться перекисному окислению, что в итоге приводило к быстрой гибели клеточных популяций. В среде же с «исправленными» кислотами клетки не только выживали, но и выходили на свой обычный уровень жизнедеятельности. Следовательно, значение перекисного окисления просто сошло на нет, утратив своё фатальное значение. Но самое интересное: для этого хватало замещения всего 15-20% от всех липидов клетки. То есть чтобы достичь нужного эффекта, совершенно необязательно замещать абсолютно все молекулы.
Дальше – больше: учёные начали тестировать соединения на животных как в норме, так и в моделях различных заболеваний, включая болезнь Альцгеймера, Паркинсона, Гентингтона, диабетическую ретинопатию, наследственные патологии типа атаксии Фридриха и других редких недугов. В общей сложности исследовано более дюжины всяческих расстройств, и везде изменённые жирные кислоты оказывали положительное действие, значительно продляя и облегчая животным жизнь.
Михаил упоминает, что проводились и эксперименты, где проверялось, не изменяет ли подобная модификация какие-то другие жизненно важные функции в клетке, не опасна ли она. Ответ однозначен – нет. Организм с дейтерием знаком, так как это – природный компонент (1 молекула на 7000 молекул обычного водорода), он никак не влияет на свойства мембраны и не изменяет свойства самих кислот, кроме того, что на порядки реже реагирует со свободными радикалами.
Как насчёт Альцгеймера?
В данный момент компания Михаила завершила доклинические исследования и уже провела первую фазу клинических испытаний дейтерированных жирных кислот на людях с атаксией Фридрейха. Это наследственное заболевание, вызванное мутацией в гене FXN, который кодирует белок фратаксин. Он содержится в митохондриях и выводит из них излишки железа. Когда он не работает, железо накапливается, что активизирует образование свободных радикалов и вызывает массовые повреждения митохондрий и клеток.
Препарат за один месяц значительно улучшал показатели многих тестов у больных людей, включая снабжение легких кислородом, физическую выносливость и ментальные функции. У счастливых пациентов в прямом смысле дата смерти немного отодвигалась.
Но, конечно, основная цель учёных – главные нейродегенеративные бичи современного обещества – болезни Альцгеймера и Паркинсона. Предварительные испытания также показали хороший эффект, но для того, чтобы вывести препарат в клиническую фазу при подобных «мегапатологиях», нужен не один десяток миллионов долларов. Поэтому решили начать с «малого» – тех наследственных патологий, которыми страдает небольшое количество людей и при которых разрешается проверять препарат сразу на больных добровольцах (согласно правилам FDA).
Михаил также возлагает большие надежды и на снижение стоимости синтеза дейтерийных жирных кислот для упрощения испытаний и в дальнейшем (если всё пройдёт успешно) – доступности лекарства для обычных людей со средним достатком. Один из его 75 коллабораторов (содружественных учёных из других лабораторий) создал метод, благодаря которому водород в нестабильных местах можно менять не поэтапно, что сильно удлиняло процесс в кислотах с множеством двойных связей (например, арахидоновой), а делать это сразу и везде.
Что же, остаётся надеяться на то, что FDA одобрит лечение, а мир, наконец, приобретёт эффективное лекарство от нейродегенеративных и других заболеваний, что в итоге, возможно, даже приведёт к продлению жизни без ухудшения её качества.
В ближайшее время на нашем портале также появится интервью с Михаилом Щепиновым.
Текст: Анна Хоружая