Исследователи описали новый тип светочувствительных белков — «криородопсины», которые встречаются в бактериях, живущих в холодных условиях, например в ледниках Гренландии и горах Тибета. Эти белки «работают» с излучением в ультрафиолетовом диапазоне.
Работа открывает новые возможности для использования родопсинов в медицине и биотехнологиях, в частности в оптогенетике, что уже успели проверить на нейронах. Результаты опубликованы в Science Advances.
Родопсины — это белки, которые помогают живым организмам реагировать на свет, видеть. Первым открытым родопсином был родопсин из сетчатки лягушки. Главная особенность родопсинов — способность менять конформацию под действием фотона определенной дины волны. Такое их свойство позволило создать метод управления отдельными нейронами, который получил широкое распространение в нейронауках — оптогенетику, о которой на нашем портале есть отдельная статья.
В новой статье описываются криородопсины, обнаруженные у микроорганизмов, живущих в холодных местах, таких как ледники Гренландии, высокие горы Тибета и вечномерзлые грунты Финляндии. Эти родопсины, приспособленные к холодному климату, были практически идентичны друг другу, хотя они эволюционировали на расстоянии в тысячи километров друг от друга. Ученые предположили, что эти белки могут быть необходимы для выживания микробов в холодных условиях.
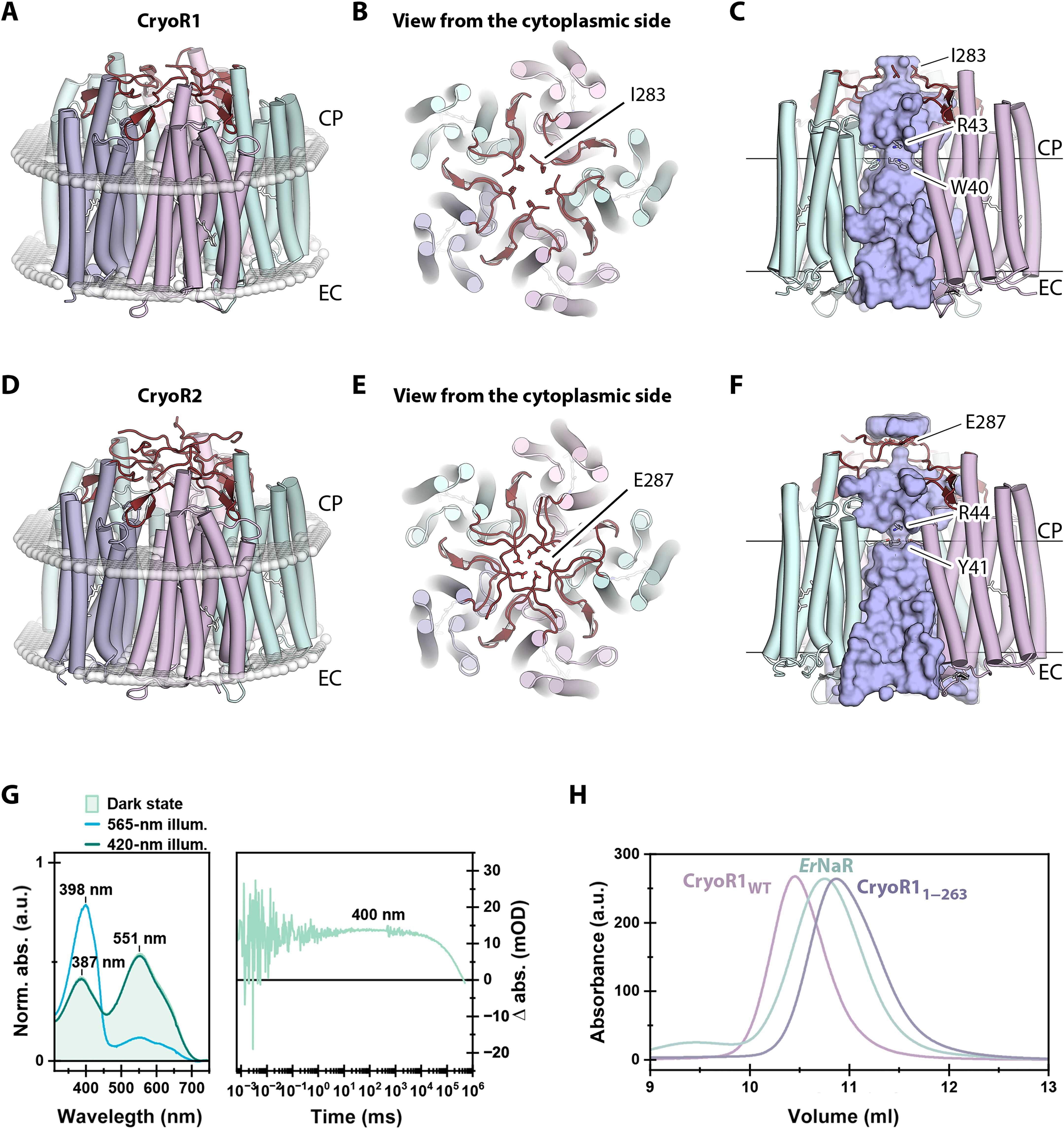
Вначале авторы проанализировали аминокислотные последовательности 40 криородопсинов, затем изучили их спектральные характеристики, а потом провели рентгеноструктурное и криоэлектронное исследование двух самых выдающихся по спектральным характеристикам белков — CryoR1 и CryoR2, которые работают как протонный насос.
Для проверки функциональности криородопсинов исследователи экспрессировали эти белки в модельных клетках мозга NG108-15, с которыми проводили электрофизиологические эксперименты на уровне отдельных клеток. Оказалось, что белок способен активироваться и в ответ на свет двух разных длин волн из видимого диапазона (хотя и недостаточно для полноценного запуска потенциала действия). Что делает криородопсины интересными как в качестве биосенсора ультрафиолета, так и для оптогенетического управления нейронами при помощи двух длин волн, что раньше было возможно лишь при использовании двух разных белков.
Для изучения взаимодействия криородопсинов с другими белками команда использовала нейросеть AlphaFold, который предсказал, что рядом с геном криородопсина всегда находится ген, кодирующий маленький белок неизвестной функции. Модель показала, что пять копий этого белка образуют кольцо, взаимодействующее с криородопсином внутри клетки. Ученые предположили, что этот белок может служить посредником для передачи сигнала о воздействии ультрафиолетового света внутрь клетки.
Используя спектроскопические исследования, ученые показали, что криородопсины реагируют на свет медленнее всех известных родопсинов.
«Мы подозреваем, что криородопсины приобрели свои уникальные свойства не из-за холода, а для того, чтобы микробы могли воспринимать ультрафиолетовое излучение, которое может быть для них опасным. В холодных условиях, например на вершине горы, бактерии подвергаются интенсивному ультрафиолетовому излучению. Криородопсины могут помочь им воспринимать его, чтобы они могли защитить себя. Эта гипотеза хорошо согласуется с нашими результатами», — отметил Кирилл Ковалев.
Текст: Оксана Гриценко