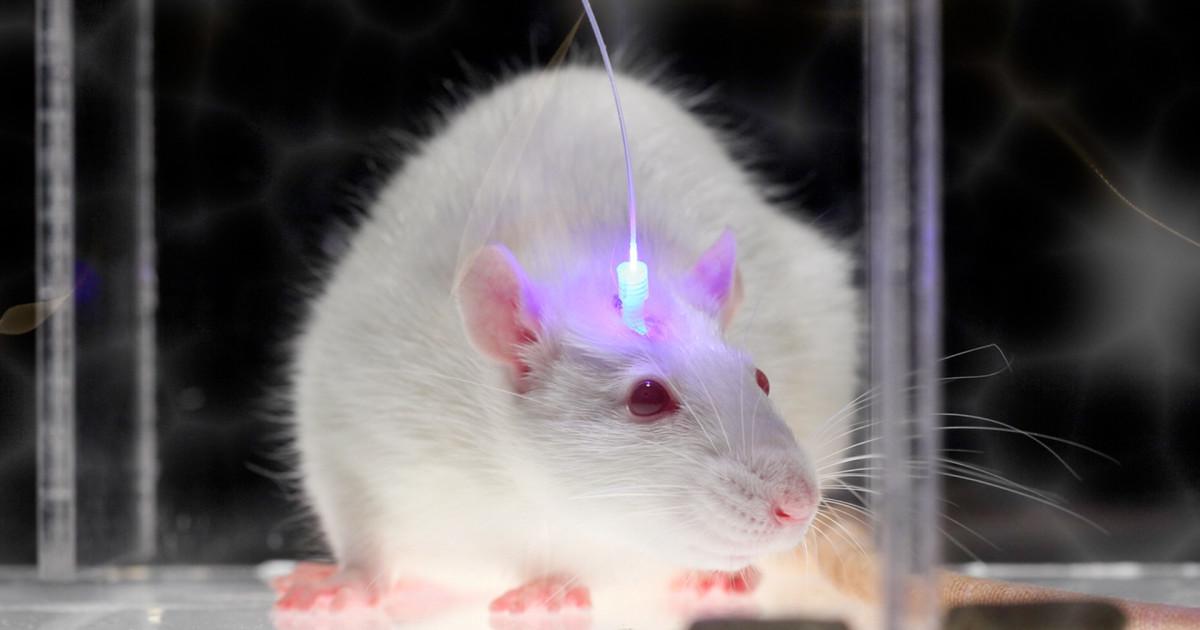
Возможность стирать память или задавать новые воспоминания, управлять движениями и поведением кажется уделом фантастических фильмов, но на самом деле этот способ уже появился и называется он «оптогенетика».
В ней объединяются воедино знания о генах, законы оптической физики и чистая нейровизуализация, позволяющая точно картировать области различных функций. Всё, что вам нужно – найти предполагаемые клетки, которые могут участвовать, например, в процессах запоминания, генетически их изменить, встроив светочувствительный белок, а затем подвести свет, который будет в определённое время их «включать» или «выключать». И все, «инструмент» по управлению функциями мозга готов.
Конечно, не стоит сильно переживать по этому поводу, так как генетические модификации с человеческим организмом пока что недопустимы. Лечение различных заболеваний методами генной терапии всё больше набирает свою мощь, но до того, пока учёные не научатся точно контролировать ход такой терапии и избегать все возможные ближайшие и отдалённые негативные последствия, говорить о скорых перспективах рано.
Однако, оптогенетические методы могут стать мощной альтернативой применению лекарственных препаратов при лечении болезни Паркинсона, депрессии, эпилепсии, тревожных расстройств, и это уже научно доказанный факт. Естественно, пока лишь только на лабораторных животных, но всё же. Не зря метод в 2010 году признан журналом Nature Methods «научным методом года», а в статье журнала Science оптогенетика названа «прорывом десятилетия» («Breakthrough of the Decade»).
Мы уже писали об оптогенетике в вопросах и ответах, теперь же решили подготовить для вас большой и подробный материал.
Ученье – свет
Итак, что же такое «оптогенетика»? Это сравнительно молодой метод, который в 2017 году отметили 12-летие с момента открытия американским учёным из Стэнфорда Карлом Дейссеротом (Karl Deisseroth) возможности таргентного (направленного) управления нервными клетками через встраивание в их мембрану светоактивных белков. Дейссерот однако не был исключительным пионером в этой области, и с методикой ему «помог» Георг Нагель (Georg Nagel), который в 2003 году «предсказал» подобную возможность, встраивая белок в яйцеклетки лягушки и клетки культуры зародыша почки человека.
Стоит отметить, что оба этих учёных открыли научному миру наиболее удобную форму светоактивного белка родопсина – канальный родопсин 2 (или ченнелродопсин-2), который, возбуждаясь светом, меняет свою структуру, открывает «врата» для положительных ионов и, тем самым, деполяризует клетку, вызывая потенциал действия – основной способ передачи информации в возбудимых тканях. Подробнее о нём и потенциале покоя мы уже писали в нашей рубрике «Нейронауки для всех».
Но сначала появилась другая техника, прототипом которой послужили наши глаза, точнее, воспринимающие свет рецепторы сетчатки, в которых содержится белок родопсин. Он состоит из белка опсина и кофактора ретиналя (производный витамина А). Свет, попадая на ретиналь, его деформирует, это вызывает структурную перестройку в белке, что уже ведёт к активации сигнальных путей внутри нейрона, вызывая его возбуждение. Метод хороший, но сложный в исполнении и очень нестабильный. Хотя сама по себе идея, высказанная ещё в 1999 году Френсисом Криком (Нобелевская премия за открытие структуры ДНК) о том, что точечно нейронами удобнее всего управлять именно светом, гениальна. Ведь свет легко дозировать и доводить до нужных клеток, что не под силу методам электрофизиологии, которые манипулируют электрическими разрядами и действуют подобно слону в посудной лавке.
Но первые опыты по встраиванию родопсина в клетки не были удачными, так как нейроны активировались очень нестабильно, что не устраивало исследователей. Пока не появилась идея «подсмотреть» подходящее вещество у светочувствительных водорослей. Именно здесь был открыт тот самый ставший впоследствии «знаменитым» канальный родопсин (ChR2), который как нельзя лучше подошёл экспериментаторам по своим свойствам.
Интересно, что опсины изучались очень широко как биохимиками, так и микробиологами, и только через многие десятки лет наконец появилась идея о том, чтобы «встретить» микробные белки и клетки млекопитающих. Оказалось, что различного рода опсины могут не только возбуждать клетку, превнося в нее положительные ионы (например, тот же чаннелродопсин-2 – неспецифический канал или бактериородопсин и протородопсин – каналы для Н+), но и подавлять генерацию потенциалов действия, гиперполяризуя мембрану (галородопсин – канал для Сl—). Не так давно в том числе нашими соотечественниками открыты и совершенно новые опсины для отрицательных ионов, которые гораздо быстрее реагируют на фотостимуляцию, чем родопсины.
Как это работает
Ответ один – через генетическую модификацию клетки. Мы должны взять ген светочувствительного белка, добавить к нему промотор, который будет «говорить» РНК-полимеразе, с какого момента нужно начать считывать с него информацию, а также присоединить так называемый репортер, чтобы проверить, правильно ли мы доставили ген и экспрессируется ли он. Чаще всего в качестве него используется какой-нибудь флуоресцентный белок (например, жёлтый YFP или зелёный GFP).
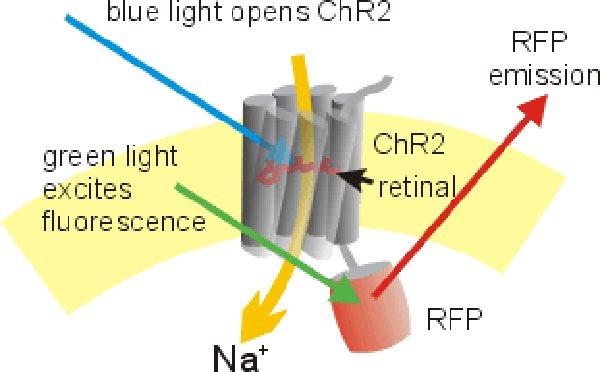
Дальше этот ген предстоит доставить в клетки, необходимые для изучения. Тут тоже есть несколько способов. Можно создать целиком генномодифицированный организм, у которого нужные нам гены уже на эмбриональном этапе развития будут встроены в геном. Это стабильнее, но на получение такого организма нужны месяцы, а ждать не сильно хочется. Поэтому существует второй способ, работающий быстрее: вирусы, несущие генетическую информацию о родопсине. Они тоже модифицированы и абсолютно безвредны для экспериментального организма, но не потеряли свою способность встраиваться в нейроны и заставлять их воспроизводить свой геном. А нам это и нужно – клетка, экспрессируя гены, доставленные вирусом, сама себя снабжает родопсинами, которые входят в мембрану и готовят её к «работе».
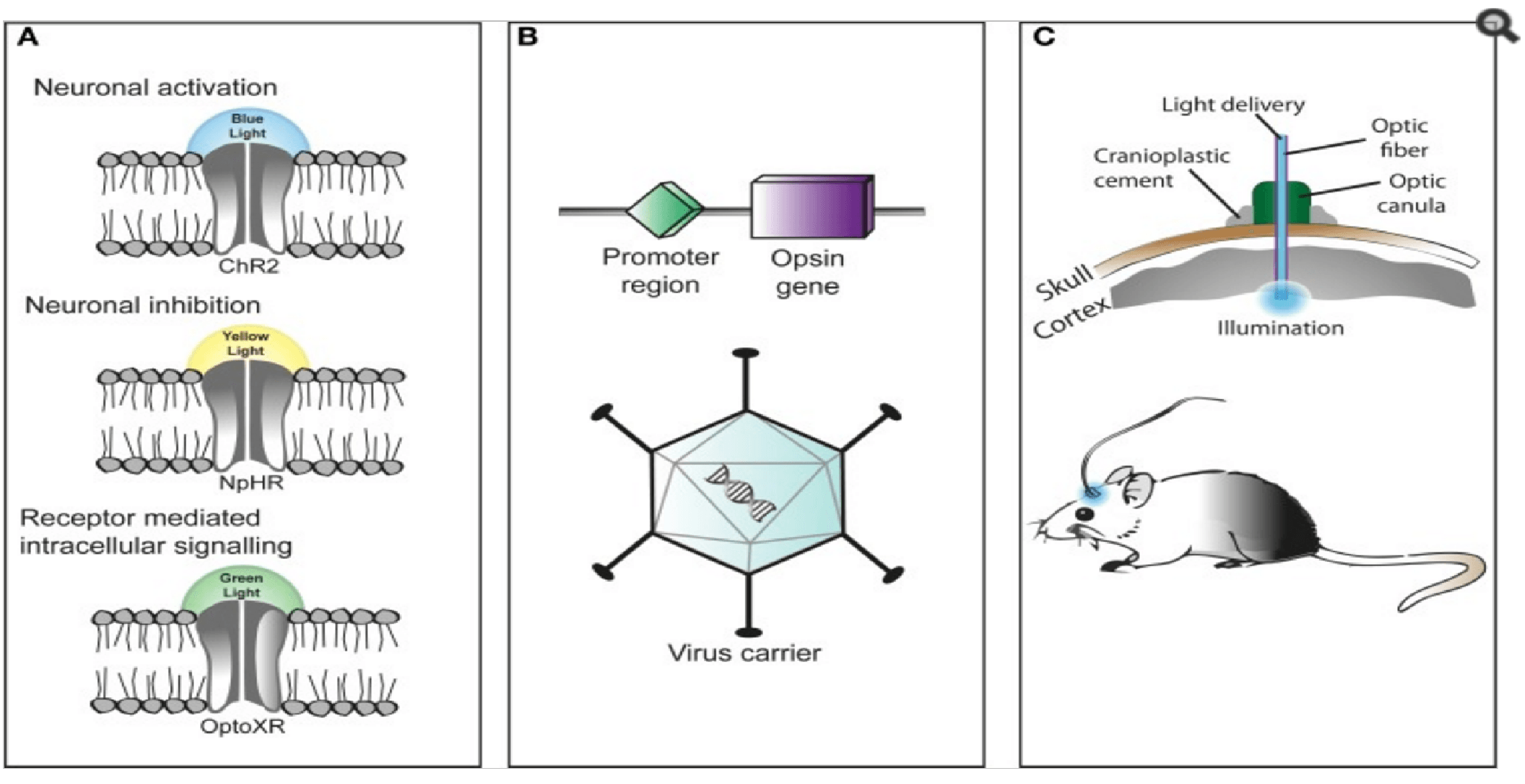
Теперь дело за малым – подвести к нужному месту источник света. Для этого используются тончайшие светодиоды из оптоволокна, отлично проводящие световые импульсы. Также к ним присоединяются электроды, позволяющие получить данные об электрической активности клеток. Такая конструкция крепится к голове животного снаружи и абсолютно не мешает ему жить своей собственной жизнью, а мы получаем возможность наблюдать за тем, что происходит с каждой конкретной клеткой в режиме реального времени, а также влиять на эти функции, варьируя световые импульсы.
Традиционные родопсины, с которых оптогенетика начала своё победное шествие по научному миру, активируются синим светом с длиной волны 480 нм, который плохо проникает в глубокие ткани. Именно поэтому необходим вживляемый в мозг светодиод. Родопсины нового поколения уже «откликаются» на свет красный, который обладает гораздо большей силой проникновения, поэтому сейчас исследователи даже получили возможность уходить от инвазивного вмешательства. Что делает весь эксперимент ещё более физиологичными, а данные – более точными и максимально приближенными к реальности.
Ложные воспоминания
Одну из наиболее показательных работ, демонстрирующих силу оптогенетики, провели в США. Коллектив японского учёного, нобелевского лауреата Судзуми Тонегава, который работает в RIKEN и в Массачусетском технологическом университете создал крыс с ченнелродопсинами-2 в областях гипоталамуса, отвечающих за консолидацию памяти – её перевод из кратковременной в долговременную, а затем проводил с ними ряд экспериментов.
Животное запоминало, что, скажем, в комнате А его били током и там нужно бояться, и реагировало на это характерным поведением (замирало и группировалось) даже тогда, когда разряда не происходило. В этот момент активизировались определённые клетки, в которые исследователи затем и внедряли родопсин. В комнате Б же всё было хорошо, и животное вело себя там как обычно до того момента, пока с помощью световых импульсов не «включали» генномодифицированные нейроны. Как вы думаете, что происходило с крысами? Правильно, они группировались и начинали пищать, испытывая страху, которому в данном контексте, казалось бы, не место.
Таким образом учёные точно установили то место в гиппокампе, где формируются воспоминания. Это зубчатая извилина и область CA1. Однако, только в апреле 2017 года они доказали, что кроме гиппокампа в запоминании участвует ещё и кора головного мозга.
Ещё более элегантный эксперимент та же лаборатория совершила в 2015 году. Учёные продемонстрировали, что при болезни Альцгеймера воспоминания не исчезают бесследно, а перезаписываются, и с помощью оптогенетики их можно вернуть. С больными модельными мышами проделывали то же, что и в других экспериментах – пугали электрическим током, только через несколько дней они об этом забывали.
Так вот, с помощью оптогенетической стимуляции не только получалось возвращать «в жизнь» потерянные воспоминания, но и делать так, чтобы они не терялись вновь. Для этого учёные внедряли родопсин в соседнюю область – энтериальную кору, стимуляция которой приводила к формированию новых связей между ней и гиппокампом и соответственно, укрепляла память.
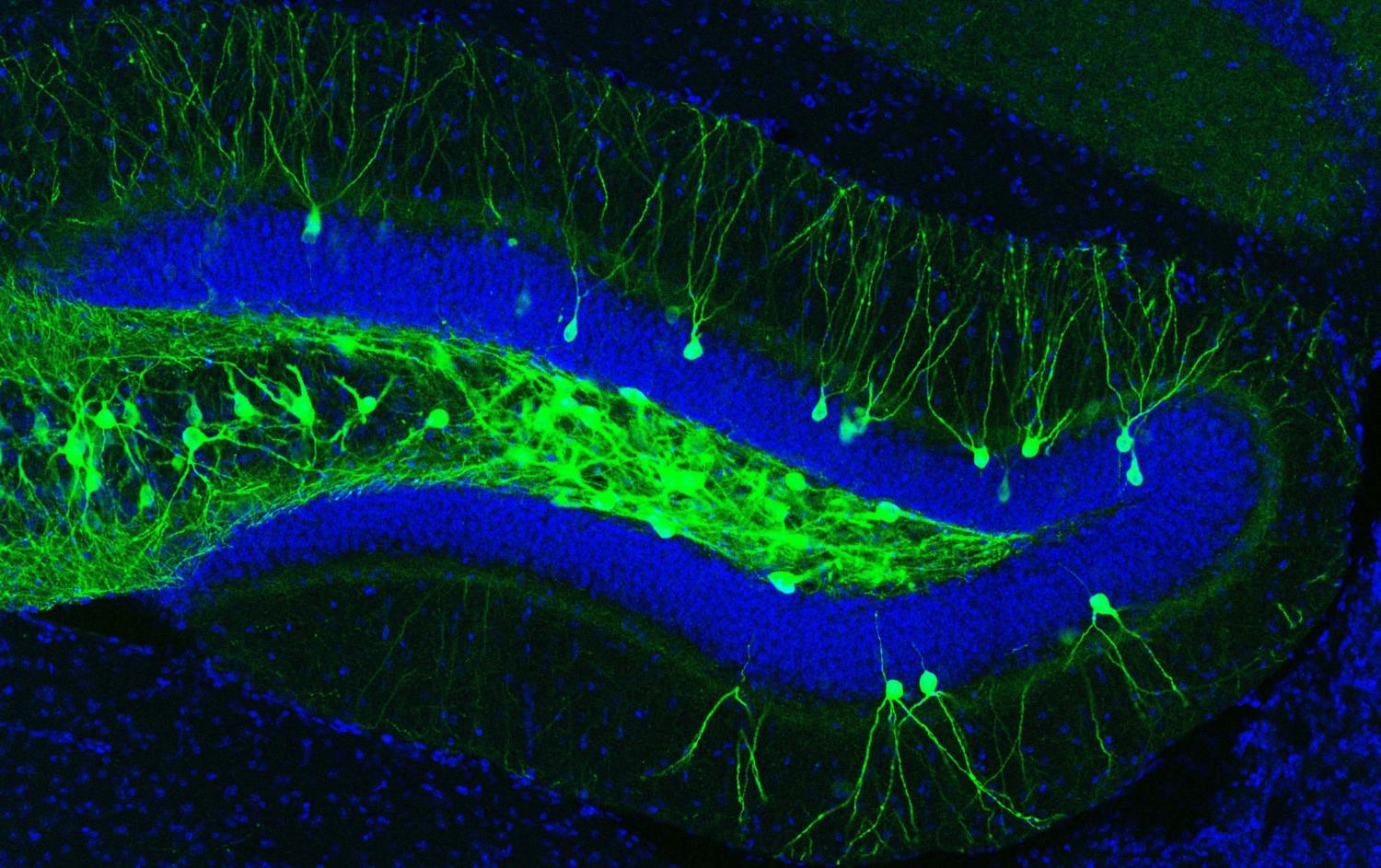
Не только память и не только родопсин
С помощью оптогенетики исследователи также доказали, что дофаминергические нейроны среднего мозга – части ствола – помимо всех своих других функций помогают воспринимать время.
Мыши слышали два звука с более кратковременными (меньше 1,5 секунды) и более длительными (больше 1,5 секунды) промежутками. Если интервал длился долго, животным было необходимо открыть левую дверцу, а если проходил быстро, то правую. В случае правильного ответа грызуны получали награду. Когда клетки, участвовавшие в этом процессе, возбуждали, то длинные промежутки воспринимались как короткие, а если подавляли, то наоборот.
В 2007 году по вине «оптогенетики» стало ясно, что для поддержания бодрствования у нас имеется еще один тип нейронов, вырабатывающих так называемый орексин или гипокретин, без которого организм бесконтрольно переходит в сон. Его выделяют лишь около 60 тысяч нейронов, которые маленькими скоплениями находятся в боковых областях гипоталамуса. Также оптогенетика «открыла» пути избавления от различного рода зависимостей, что в будущем наверняка станет неоценимой помощью в работе психиатров.
Помимо всего этого можно встраивать родопсины в мембраны кардиомиоцитов, управляя таким образом сердечным ритмом, а можно и вовсе создать «универсальных убийц» — клетки, которые под воздействием света будут выпускать в окружающее из пространство активные формы кислорода, крайне разрушительные и токсичные для живых мембран. Применение такой вид клеток наверняка сможет найти в онкологии. Оптогенетическими методами можно будет подавлять боль и восстанавливать зрение.
Светочувствительностью, как оказалось, обладает не только родопсин. Есть почвенные бактерии, у которых на свет реагируют некоторые ферменты, в частности, аденилатциклаза, которая производит функционально активное вещество цАМФ. Таким образом получилось простимулировать регенерацию отростков нервных клеток, в которые был введён этот самый фермент, так как чем больше цАМФ в клетке, тем активнее в ней происходят синтетические процессы. Скорость регенерации в этом случае возросла в 6 раз по сравнению с теми клетками, которые находились в темноте. Особо ценно то, что эксперименты проводились на живых рыбах, и ни одна из них не пострадала.
Что в России?
Согласно данным 2015 года, предоставленным коллективом авторов РАНХиГС, Россия по количеству публикаций в этой теме занимает место не в первой десятке (14-е место). Лидирует здесь Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, что, в общем-то, неудивительно, так как одними из первых в России оптогенетикой начали заниматься именно они.
В 2012 году на базе Санкт-Петербургского политехнического университета под руководством Ильи Безпрозванного, профессора Юго-западного медицинского центра Университета Техаса (США) и выпускника Политехнического института, начала функционировать лаборатория молекулярной дегенерации, которая стала северным оптогенетическим «центром».
Московские же учёные объединились в команду и в 2013 году выиграли конкурс проектов комплексных междисциплинарных фундаментальных исследований (КОМФИ). Их проект назывался «Нейрооптогенетика: интеграция новых подходов в оптике и молекулярной генетике для исследований функций мозга и его пластичности», а возглавил его Павел Балабан, директор Института высшей нервной деятельности и нейрофизиологии РАН и заведующий там лабораторией клеточной нейробиологии обучения. В коллектив авторов вошли руководитель группы биологии активных форм кислорода в ИБХ РАН Всеволод Белоусов, руководитель отдела нейронаук НИЦ «Курчатовский институт» Константин Анохин и заведующий лабораторией фотоники и нелинейной спектроскопии физфака МГУ, руководитель группы «Передовая фотоника» Российского квантового центра Алексей Жёлтиков. Мультидисциплинарный подход налицо.
Совсем недавно у этих авторов вышла прорывная статья в журнале Nature Communications, в которой опубликован новый шаг в развитии метода: оптогенетика превратилась в термогенетику, в которой в мембрану нейрона встраивают термочувствительные белки. О новом методе нашему порталу рассказал сам Всеволод Белоусов.
В последние годы лаборатории, занимающиеся методами оптогенетики появились также в МФТИ и Нижнем Новгороде.
Текст: Анна Хоружая