Исследование группы учёных Школы медицины Университета Северной Каролины показывает, что удаление специфического белка в клетках-предшественниках приводит к нарушению развития мозга.
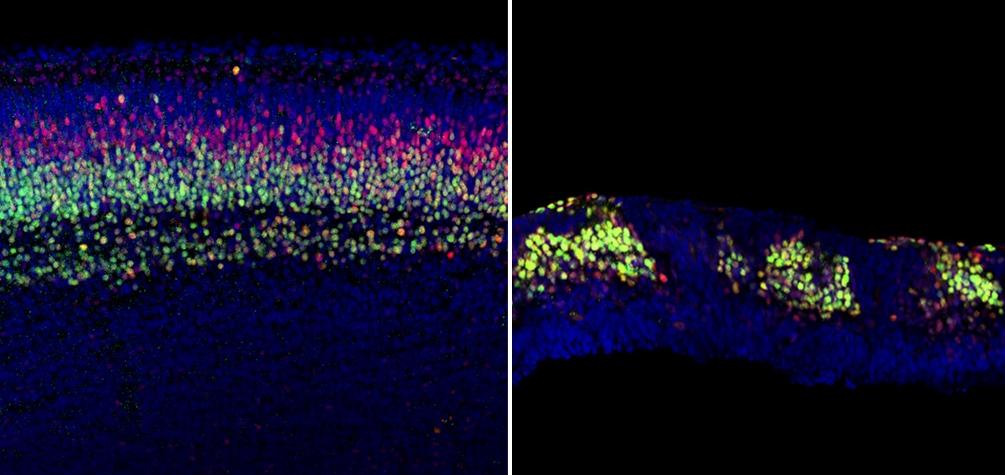
Исследователи предполагают, что нарушение передачи клеточных сигналов может спровоцировать развитие аутизма, так как некоторые гены, ассоциированные с аутизмом экспрессируются уже в клетках-предшественниках нейронов. Исследование опубликовано в Genes & Development.
По мере развития мозга эмбриона происходит крайне сложный каскад клеточных событий, начиная с клеток-предшественников нейронов – стволовых клеток, которые впоследствии преобразуются исключительно в нейроны, благодаря чему формируется кора головного мозга. Если этот каскад «неисправен», если хоть один белок в нём не выполняет свою работу, тогда мозг может развиться неправильно.
Белок Wnt участвует в сигнальном каскаде, который связан с генами, отвечающими за аутизм. В основе главного пути Wnt-сигнализации лежит стабилизация цитоплазматического белка β-катенина. Белок APC (так называемый белок аденоматозного полипоза толстой кишки) играет очень важную роль в процессе контроля клеточного деления.
Учёные Школы медицины UNC под руководством Эвы Энтона, PhD, доктора клеточной биологии и физиологии, показали, как удаление белка APC в клетках-предшественниках приводит к сбоям в каноническом пути Wnt и к обширным нарушениям развития мозга.
«Мутации в гене АРС человека нарушают способность клеток-предшественников адекватно реагировать на связанные с внешней средой сигналы, необходимые для их [клеток] деления, а также производить нейроны в ходе развития мозга и перемещаться в нужное место», – говорит Энтон.
В развивающемся мозге эмбриона Wnt запускает так называемый комплекс деградации внутри цитоплазмы клетки-предшественника. Этот комплекс разрушает белок β-катенин, тем самым ограничивая способность β-катенина проникать в ядро. Пока клетки-предшественники нейронов делятся, контроль доступа β-катенина к ядру играет важную роль в экспрессии генов и в итоге влияет на то, как создаются нейроны и как они направляются в нужные места в разных частях мозга.
В экспериментах под руководством Наоки Накагавы, постдока в лаборатории Энтона, учёные UNC исследовали, что произойдёт, если они изменят комплекс деградации. Одним из белков в этом комплексе является APC. Когда Накагава удалял APC, β-катенин становился неконтролируемым, вызывая нерегулируемые паттерны экспрессии генов в клетках-предшественниках.
«Если это происходит, все разваливается, – сказал Энтон. – мозг не формируется должным образом. Если белковый комплекс не уничтожает β-катенин, то Wnt аномально активирует гены у прогениторов, заставляя их вести себя неправильно».
Когда Накагава понижал титр β-катенина у мышей, которым не хватало APC, мыши развивались нормально. В другом эксперименте группы Энтона при гиперактивации β-катенина независимо от APC мозг развивался неправильно.
«Это показало нам, что проблемы действительно вызывало дерегулирование β-катенина, – говорит Энтон. – И именно APC в этом белковом комплексе является ключом к правильному регулированию».
Далее команда Энтона планирует сосредоточиться на генах, которые могут вызывать аутизм. Некоторые из этих генов экспрессируются в прогениторах. Если эксперименты на мышах пройдут успешно и покажут, что передача сигналов Wnt у клеток-предшественников включает гены аутизма, тогда учёные начнут работу с клетками-предшественниками человека, чтобы исследовать, действительно ли эти клетки поражены у пациентов с аутизмом.
«Мы хотим посмотреть, не приведёт ли дерегуляция сигналов Wnt к изменениям экспрессии и функционирования синдромных генов аутизма у человеческих прогениторов, – сказал Энтон. – Хотя дефекты прогениторов нельзя лечить в зрелых нейронах головного мозга, с такими исследованиями мы могли бы, по крайней мере, определить, что изменилось и как помочь людям, у которых аутизм развивается из-за минимальных, но критически важных изменений мозга в пренатальный период».
Текст: Полина Гершберг