Ученые из Гарвардской медицинской школы определили как бактерии, преодолевая защитные оболочки, проникают в мозг и используют нервные клетки для подавления иммунного ответа.
Результаты нового исследования положат начало применения новых соединений для лечения заболевания, известного как бактериальный менингит. Исследование опубликовано в Nature.
Менингит — воспаление мозговой оболочки с тяжелыми последствиями и возможным летальным исходом. Бактерии являются наиболее распространенными патогенами, способствующие развитию заболевания. Ежегодно регистрируется около 1,2 миллиона случаев заражения бактериальным менингитом и без вмешательства болезнь убивает семь из десяти инфицированных. В случае лечения цифра снижается до трех из десяти, но среди выживших, даже в случае своевременного применения антибиотиков и стероидов, каждый пятый испытывает серьезные нарушения слуха и зрения, эпилепсию, хроническую головную боль и другие неврологические осложнения.
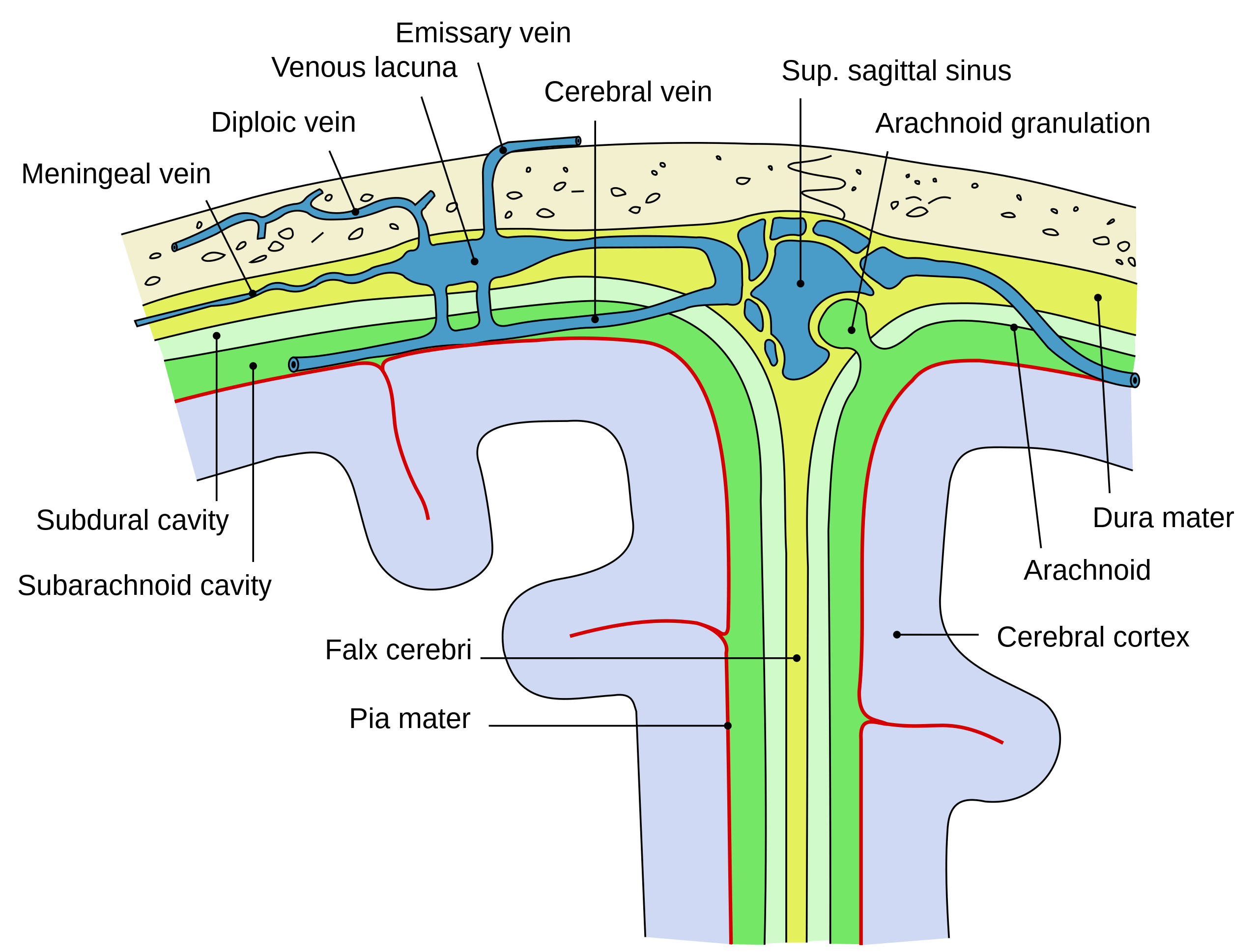
Развитие заболевания начинается с взаимодействия бактерий с мозговыми оболочками — защитными слоями головного и спинного мозга. В новом исследовании ученые сосредоточились на изучении внешнего слоя, так называемой, твердой мозговой оболочке. Выяснилось, что здесь содержится множество иммунных клеток, находящихся в тесном взаимодействии с нервными клетками.
Исследуя влияние двух наиболее распространенных патогенов бактериального менингита (Streptococcus pneumoniae и Streptococcus agalactiae) в серии экспериментов на мышах ученые смогли проследить поэтапный путь проникновения инфекции. Оказалось, что бактерии выделяют токсин, который активирует болевые нейроны в мозговых оболочках, что объясняет сильную головную боль при менингите.
Активированные нейроны выделяют нейропептид кальцитонин ген-связанный пептид (CGRP). Эта молекула связывается с рецептором иммунных клеток RAMP1, который особенно распространен на поверхности макрофагов. Воздействие CGRP на рецептор «выключает» иммунную клетку, не давая ей атаковать и уничтожать бактерии, а так же посылать сигналы другим иммунным клеткам для обеспечения второй линии защиты организма. В результате бактерии беспрепятственно размножаются и вызывают инфекцию.
Для подтверждения того, что активация болевых нейронов является первым этапом отключения иммунной защиты мозга, исследователи проверили путь инфицирования на мышах, у которых отсутствовали болевые нейроны.
Оказалось, что у этих нокаутных животных развивались менее серьезные инфекции и мозговые оболочки имели высокий уровень иммунных клеток. Мыши с неповрежденными болевыми нейронами показали слабый иммунный ответ и меньшее количество активированных иммунных клеток, что говорит о захвате нейронов бактериями и начале разрушения защиты.
Оставалось подтвердить, что каскад реакций начинается именно с выделения CGRP. Для этого исследователи сравнили уровни CGRP в мозговых оболочках инфицированных мышей с неповрежденными болевыми нейронами и нокаутов. Выяснилось, что в клетках мозга нокаутов уровни CGRP и присутствие бактерий были минимальными, а клетки мозговых оболочек животных с неповрежденными болевыми нейронами показали повышенный уровень как CGRP, так и большее количество бактерий.
Проведенное исследования позволило определить путь борьбы с заболеванием. Решение кроется в блокировке рецептора RAMP1 и предотвращении его связи с CGRP, что так же подтвердилось в серии экспериментов: у животных, заранее обработанных блокаторами RAMP1, наблюдалось снижение присутствия бактерий в мозговых оболочках. Аналогично, мыши, получавшие блокаторы через несколько часов после заражения и регулярно после этого, имели более легкие симптомы и были способны бороться с патогенами.
Блокатор RAMP1 работает в качестве профилактики бактериального менингита и лечения после заражения. Кстати, ингибиторы CGRP и RAMP1, содержатся во многих препаратах для лечения мигрени, поскольку считается, что это состояние возникает именно в слоях твердой мозговой оболочки — месте первого столкновения бактерий и иммунных клеток.
Результаты работы команды Гарвардской медицинской школы позволили определить соединения, способные остановить развитие заболевания на разных стадиях. Станут ли блокаторы основой новых лекарств для лечения бактериального менингита — главный вопрос дальнейших исследований.
Текст: Елена Оганесян