Долгое время нервная и иммунная системы рассматривались как независимые иерархии, каждая со своими функциями и механизмами. Однако накопленные за последние годы данные заставляют пересмотреть эту картину.
Оказывается, нейроны и иммунные клетки ведут постоянный диалог, обмениваясь цитокинами, нейромедиаторами, нейропептидами и факторами роста. В журнале Signal Transduction and Targeted Therapy недавно появился мини-обзор южнокорейских ученых, в котором они систематизируют современные представления о двунаправленном взаимодействии нервной и врожденной иммунной систем. Сам этот обзор небольшой, но мы посчитали важным рассказать о нем читателям в нашем пересказе.
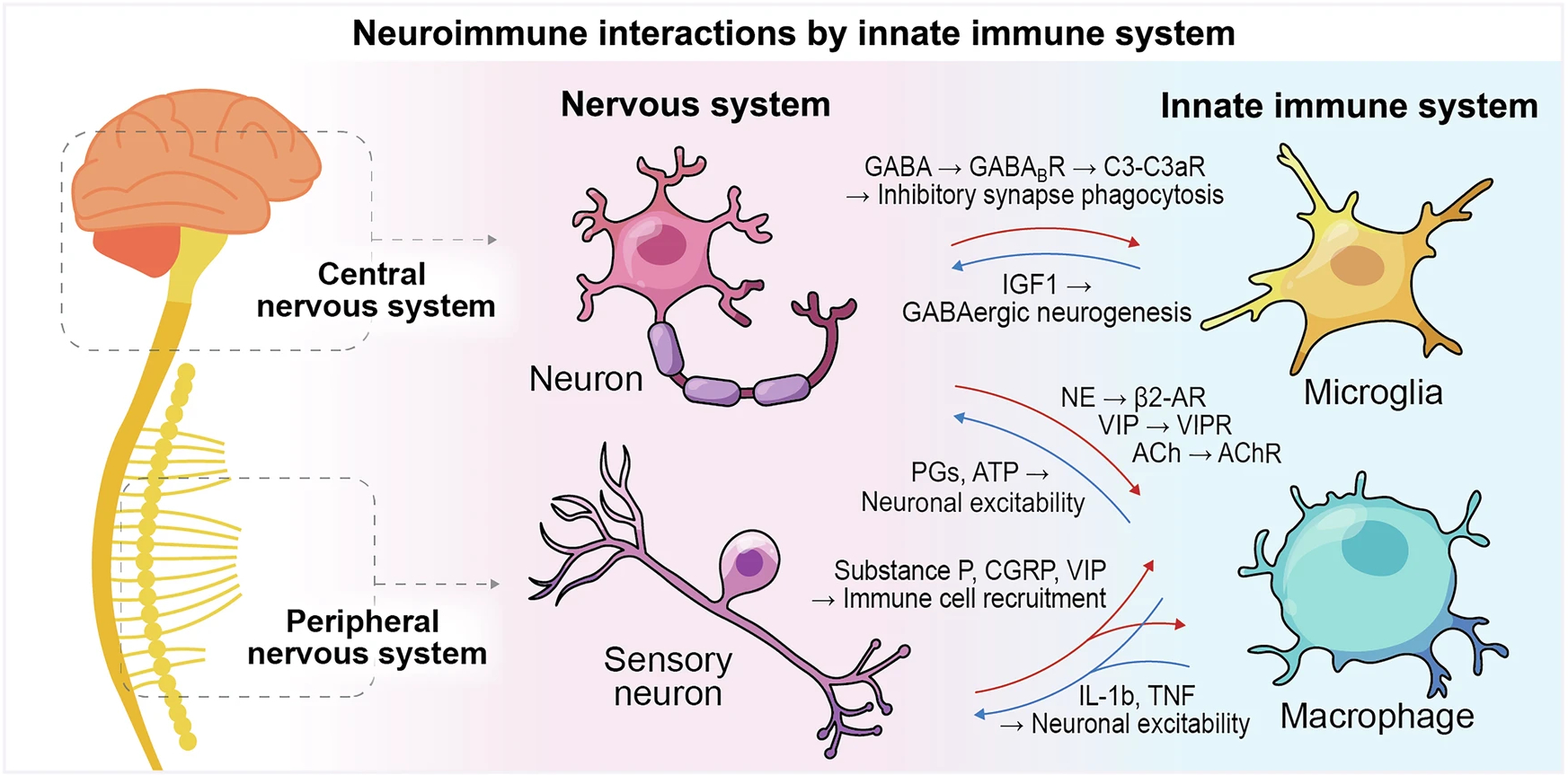
Поводом для мини-обзора стала летняя публикация в Nature группы исследователей, которые обнаружили, что микроглия – постоянно «обитающие» в мозге иммунные клетки – регулирует ГАМКергический нейрогенез в мозге развивающегося плода с помощью инсулиноподобного фактора роста 1 (IGF1). Это открытие переопределяет роль микроглии: из простых «иммунных часовых» они превращаются в «архитекторов развития», направляющих формирование тормозных нейронных цепей. Авторы обзора подчеркивают, что это исследование не только раскрывает ранее неизвестный нейроиммунный механизм формирования человеческого мозга, но и создает концептуальную связь между иммунной сигнализацией и сборкой нейронных контуров, что может иметь значение для понимания того, как нарушается развитие нервной систем и развиваются, например, расстройства аутистического спектра или эпилепсия.
Нейроиммунные синапс и коннектом
Для описания взаимодействий между нервной и иммунной системами авторы обращаются к концепции, предложенной Майклом Уилером и Франциско Кинтаной. Согласно этой модели, существуют два уровня организации.
Нейроиммунный синапс представляет собой фундаментальную клеточную единицу коммуникации – специализированный поляризованный контакт между клетками с пространственно организованной экспрессией сигнальных молекул и соответствующих рецепторов. Нейроиммунный же коннектом в свою очередь охватывает всю совокупность нейроиммунных взаимодействий, формирующих сеть системного уровня, которая объединяет синаптические единицы между клетками, тканями и органами.
Ранние исследования фокусировались преимущественно на взаимодействиях Т-клеток и нейронов в контексте адаптивного иммунитета. Однако появляющиеся данные демонстрируют, что клетки врожденного иммунитета напрямую «общаются» с нейронами.
Нейроны перепрограммируют макрофаги
Особенно ярко этот процесс проявляется в кишечнике, где энтеральная нервная система непосредственно модулирует кишечные макрофаги, согласовывая иммунный тонус с физиологическими потребностями. Исследователи показали, что определенный тип нейронов высвобождает нейромедиаторы, которые активируют рецепторы на макрофагах кишечника. Это запускает тканезащитную транскрипционную программу с экспрессией разных маркеров. Нейрогенные сигналы определяют фенотипы макрофагов: провоспалительный при инфекции или поддерживающий равновесие в условиях гомеостаза.
Авторы обзора подчеркивают, что нейрональное перепрограммирование макрофагов меняет вообще саму парадигму врожденного иммунитета. Макрофаги не пассивно реагируют на цитокины, а динамически отвечают на нейромедиаторы – ацетилхолин, норэпинефрин, вазоактивный интестинальный пептид (VIP). В ответ они изменяют нейрональную возбудимость через простагландины и АТФ, формируя локальный регуляторный контур на тканевом уровне.
Если кишечные макрофаги подвергаются периферическому перепрограммированию со стороны нейронов, то микроглия действует по аналогичному принципу в центральной нервной системе. Помимо роли «строителей синапсов», координирующих сборку контуров, при патологических состояниях микроглия выступает «скульптором синапсов». Ученые сообщают, что ГАМК-зависимое, опосредованное микроглией удаление тормозных синапсов лежит в основе нейрональной гипервозбудимости при эпилепсии. Гиперактивные ГАМКергические нейроны активируют ГАМК-рецепторы микроглии, запуская направленный фагоцитоз («пожирание») тормозных синапсов. Такое целенаправленное удаление нарушает баланс возбуждения и торможения и способствует судорогам. Кроме того, этот процесс можно обратить блокадой ГАМК-сигнализации.
Такая двойственность – содействие формированию синапсов в развитии и их устранение при патологическом стрессе – подчеркивает динамическую «разносторонность» нейроиммунного синапса, где нейрональная активность направляет поведение микроглии, а микроглиальная сигнализация активно перестраивает коннектом мозга.
Нейроны как сенсоры врожденного иммунитета
Финальный элемент этой картины – признание того, что сами нейроны функционируют как сенсоры врожденного иммунитета. В одном из обзоров сенсорные нейроны описаны как встроенные компоненты врожденного иммунитета. Сенсорные нейроны экспрессируют определенный тип рецепторо – паттерн-распознающие рецепторы (PRR). Это позволяет им напрямую «замечать» микробные продукты и молекулярную «атмосферу», ассоциированную с повреждением. При активации эти нейроны высвобождают нейропептиды – субстанцию P, кальцитонин-ген-связанный пептид, VIP – которые организуют мобилизацию иммунных клеток и сосудистые реакции. В свою очередь, цитокины IL-1β и TNF изменяют нейрональную возбудимость и восприятие боли (в сторону усиления), замыкая двунаправленную петлю обратной связи.
Авторы обзора отмечают, что функционируя как сенсоры врожденного иммунитета, нейроны, возможно, способны формировать долговременную «нейрональную иммунную память», что подтверждается эпигенетическими данными. Такие возможности позволяют фундаментально по-новому взглянуть на нейроны. Возможно, нас ждет эволюция нейроиммунного синапса от просто структурного контакта к функциональной иммунной органелле – месту, где пересекаются синаптический, метаболический и иммунный «языки».
Выводы и терапевтические перспективы
Авторы заключают, что нервная и врожденная иммунная системы переплетены гораздо глубже, чем считалось ранее. Это взаимодействие не однонаправленно, а реципрокно (то есть двухстороннее) и интегративно: нейроны перепрограммируют иммунитет макрофагов, влияют на состояние микроглии, она, в свою очередь, опосредует удаление синапсов, а еще нейроны работают как иммунные распознаватели. Нейроиммунный синапс – не пассивный интерфейс, а активный пластичный узел, где сливаются две разные программы.
Это понимание открывает терапевтические возможности: например, направленное торможение микроглиального прунинга (удаления синапса) или блокада активации через ГАМКB-рецепторы, чтобы при эпилепсии не терялись нейронные «тормоза». Также можно влиять на сигнализацию между нейронами и макрофагами для восстановления иммунного баланса при воспалительных заболеваниях кишечника, а еще воздействовать на нейрональные PRR-пути для нейроиммунной активации при инфекциях или нейродегенерации.
Как пишут авторы, это объединение означает не конец границ, а появление новых рубежей – там, где нейроны действуют как иммунные клетки, а иммунитет действует как нервная система.
Текст: Анна Хоружая