От ребенка в утробе матери до окружающего мира — всего несколько сантиметров мягких тканей и мышц. Несколько сантиметров, через которые нужно пройти, чтобы спасти жизнь — если внутри что-то пошло не так.
Но барьеров на этом пути немало, причем как физических, так и этических. Рассказываем о том, как фетальные хирурги их преодолевали и кого (и от чего) научились спасать.
В 1999 году американский фотограф Майкл Клэнси запечатлел руку младенца, обхватившую палец хирурга. Снимок получил название «Рука надежды» и быстро разлетелся по газетам. Но примечателен он не тем, что противники абортов потом еще много лет использовали его как аргумент в пользу прав младенца. И даже не тем, что хирург Джозеф Брюнер впоследствии уверял, что кадр неправильно интерпретировали: это он поддерживал руку ребенка, а не ребенок хватался за его палец. А тем, что детская рука торчала из утробы матери. Формально пациент Брюнера еще не родился — до появления на свет ему оставалось около двух месяцев.
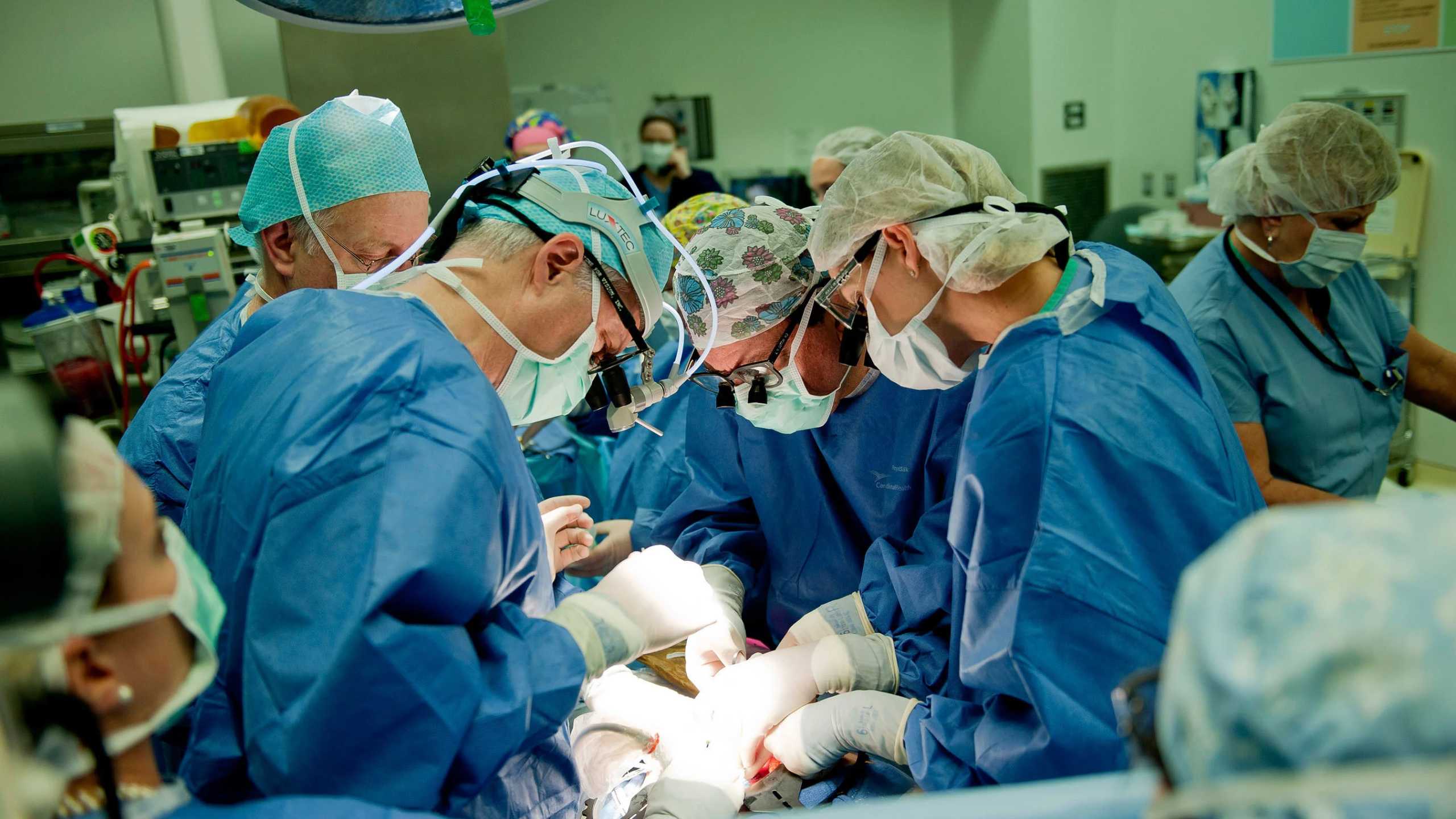
Фетальная хирургия принципиально не сильно отличается от обычной: наркоз, зажим, скальпель, контроль ЭКГ. Разве только тем, что температура в операционной выше — на уровне материнского тела, чтобы не переохлаждать плод. А еще тем, что самое сложное и опасное начинается не до операции, а после.
Пройти сквозь стену
На пути фетального хирурга к развивающемуся ребенку лежит несколько слоев материнского тела: кожа, подкожная клетчатка, капсула матки, ее же мышечная стенка и, наконец, амнион — внешняя оболочка зародышевого пузыря. Пройти сквозь них несложно — медики успешно занимались этим еще с конца XIX века. Правда, долгое время им приходилось искать плод на ощупь и протыкать стенку матки вслепую. Поэтому единственное, чем врач мог помочь беременной женщине — это высосать из зародышевого пузыря излишек амниотической жидкости, чтобы та не давила на зародыш. Или забрать ее небольшую порцию на анализ, чтобы определить, вступил ли плод с матерью в резус-конфликт и несет ли в себе генетическую аномалию.
Только в 1970-х годах, с появлением в больницах аппаратов УЗИ, стало возможным проткнуть матку прицельно, чтобы точно не попасть ни в плод, ни в плаценту (или наоборот, попасть, если нужно именно это). А затем детский хирург Майкл Харрисон предположил, что если внутрь матки проходит игла, то можно попробовать и с хирургическими инструментами.
Подтвердив свои предположения на макаках, Харрисон перешел к людям, и в 1981 году он представил миру Майкла Скиннера, которого он прооперировал еще до рождения, на 32-й неделе развития (а Майклом мальчика назвали уже после рождения, в честь самого врача). Мальчик страдал гидронефрозом: из-за непроходимости уретры моча скапливалась у него в почках, раздувая брюшную полость, травмируя сами почки и прижимая легкие. Если бы Харрисон не вмешался, Майкл мог бы не дожить до родов или умереть в первые дни жизни.
Хирург взял 17-сантиметровую иглу с диаметром 1,27 миллиметра и проткнул ей сначала кожу матери, затем стенку матки, а потом и стенку тела маленького Майкла — так, что попал прямо в его мочевой пузырь. Через иглу Харрисон ввел в тело мальчика полиэтиленовый катетер — трубку, которая выводила жидкость из мочевого пузыря наружу, в амниотическую полость.
Мальчик появился на свет через две недели. Его пришлось дооперировать уже снаружи от матери, чтобы извлечь катетер и восстановить проходимость уретры (этого Харрисон внутриутробно сделать не смог), но в остальном он был вполне здоров. К полутора годам он уже уверенно стоял на ногах, а через двадцать лет — собирался учиться на медбрата. Спасший его катетер назвали шунтом Харрисона, а технология легла в основу современной фетоскопии: многие инструменты, которые нужны для операций на зародышах, в том числе видеокамеры, вводят в матку именно так, через проколы в стенке тела.
Задача, которая стояла перед Харрисоном, осложнялась еще одним обстоятельством. Майкл был в материнской утробе не один. Рядом с ним сидела будущая Мэри Скиннер — совершенно здоровая. Если бы Харрисон в ходе операции повредил матку, жизнь Мэри тоже оказалась бы под угрозой. Это был уникальный эксперимент: через год после него сам Харрисон вместе с другими врачами решил, что больше так рисковать не стоит. С тех пор при многоплодных беременностях внутриутробные операции обычно не назначают.
Но не всегда близнецы так мирно уживаются друг с другом внутри утробы, как Майкл и Мэри. Сосуды, ведущие в плаценту от разных плодов, могут перепутаться или даже срастись между собой. В таких случаях один из близнецов может оттягивать на себя кровь из общего русла — отчего второму не хватает питательных веществ, и он замедляется в развитии. Этот конфликт сейчас тоже умеют разрешать с помощью фетальной хирургии. Для этого в полость матки вводят фетоскоп, находят дефектные сосуды и прижигают их лазерным лучом, разделяя кровотоки близнецов.
Частично рожденные
Если можно сделать в матке отверстие и просунуть в него хирургические инструменты, то что мешает вытянуть часть плода наружу, чтобы оперировать было удобнее? Вскоре после своей нашумевшей внутриутробной операции Майкл Харрисон решился перейти на следующий уровень — к открытой фетальной хирургии.
Его новой мишенью стала диафрагмальная грыжа — патология, которую одним катетером не исправить. У пациентов с такой грыжей диафрагма вырастает не сплошной, и сквозь отверстие в ней органы из брюшной полости — например, желудок и печень — могут перебраться в грудную, где давят на легкие и мешают им развиваться. Органы можно вернуть на место и после родов — но есть риск, что легкие, которым грыжа не давала расти полноценно, окажутся настолько маленькими и слабыми, что не смогут восстановиться даже на аппарате искусственной вентиляции. Харрисон и его коллеги подсчитали, что дети, которым вправляли грыжу после рождения, умирали в 75 процентах случаев. И попробовали это предотвратить.
В 1990 году они рассказали, как у них это получилось. Пациентом снова был мальчик — хотя в отчете, что характерно, врачи называют пациентом его мать, — возрастом 24 недели, у которого левого легкого на УЗИ почти не было заметно: его место заняли желудок, часть кишечника, печень и селезенка. Чтобы добраться до ребенка, Харрисон сделал небольшой разрез на животе женщины, закрепил края разреза зажимами и откачал из полости матки амниотическую жидкость, в которой плавал плод. Сквозь образовавшуюся щель Харрисон нащупал левую руку мальчика и вытащил ее наружу.
Ребенок прижался левой половиной груди к разрезу изнутри — этого оказалось достаточно, чтобы оперировать его по тому же принципу, что и взрослых. Хирурги сделали разрез под его ребрами, втянули органы обратно в брюшную полость, а освободившееся пространство в между легкими заполнили теплым раствором. На диафрагму поставили заплатку из Gore-Tex (водонепроницаемый мембранный материал, родственник того, которым укрепляют туристическую одежду), и еще одну — на место разреза, чтобы брюшная полость стала пошире и в нее влезли все вправленные органы.
Амниотическую жидкость вернули на место — теплой, разведенной физраствором и с добавлением антибиотика. Матку зашили послойно, и убедились в том, что сердце ребенка бьется так же часто, как и до операции. Через неделю на УЗИ стало видно, что легкое мальчика расправилось, а через семь недель он родился. Поначалу ему потребовались вентиляция легких и еще одна операция, чтобы окончательно избавиться от последствий грыжи — но после этого его признали совершенно здоровым.
Потом Харрисон взялся проводить новые операции — например, по расчистке легких от аденоматозной кисты, а его коллеги задумались о том, что какие еще возможности открывает внутриутробная хирургия. В конце концов, чем раньше начать лечить болезнь, тем легче с ней справиться. Были даже предложения проводить внутриутробно пластические операции — ткани у плода все равно срастаются легче, чем у новорожденного, и есть шанс, что удастся исправить какие-нибудь пороки развития, вроде заячьей губы, и обойтись без шрамов. Все эти операции, кроме того, выглядели способом снизить число абортов: у родителей, которые раньше могли только лишить больного ребенка жизни или обречь его на боль, операции и вечную зависимость от врачей, мог появиться третий вариант.
Но область развивалась небыстро. Возможно, потому что сами создатели фетальной хирургии, в том числе и Харрисон, помнили, какой ценой им достались слава и успех. Майкл Скиннер был не первым пациентом команды Харрисона. Его предшественник не выжил: хотя сама операция на почках и последующие роды прошли успешно, оказалось, что внутренние органы ребенка были слишком сильно повреждены в ходе операции, чтобы заработать самостоятельно.
Диафрагмальную грыжу Харрисон тоже вправил не с первой попытки. Прежде чем газеты начали писать о его операции на наполовину извлеченном из утробы ребенке, умерли шестеро таким же образом прооперированных детей. В трех случаях у врачей не вышло аккуратно вернуть на место печень, при этом они нарушили отток крови от нее. В четвертый раз на печени не прижилась заплатка, а еще в двух случаях вмешались не зависящие от хирургов обстоятельства.
Вопросы возникли и к успешным исходам операций: действительно ли дети выжили благодаря вмешательству Харрисона, а не вопреки? Майкла Скиннера прооперировали за две недели до родов — не значит ли это, что он продержался бы это время и без катетера? И правда ли диафрагмальная грыжа так опасна? Критики Харрисона обвинили его в том, что он преувеличил риски своих пациентов: по подсчетам других врачей, при правильном лечении дети с такой грыжей выживают в 78-90 процентах случаев. А если так, то стоит ли подвергать еще не родившегося ребенка ненужным рискам?
От некоторых внутриутробных операций врачи уже отказались. Так, например, в 1982 году последователи Харрисона попробовали внутриутробно вылечить гидроцефалию — отек головного мозга. Для этого избыток жидкости откачивали из желудочков мозга иглой или ставили катетер, который отводил ее в амниотическую полость. Но после нескольких десятков подобных операций врачи посмотрели на статистику выживаемости и согласились: она ничем не отличается от выживаемости тех, кого лечат уже после появления на свет. И наложили на внутриутробное лечение гидроцефалии мораторий.
С тех пор всем, кто решился опробовать новый метод фетальной хирургии, приходилось доказывать, что риск оправдан — и Харрисону в том числе. Поэтому, например, его метод вправления диафрагмальной грыжи не прижился: проведя клиническое испытание, сам Харрисон признал, что выживаемость детей при этом не растет. Он переключился на другой метод: в трахею ребенку вставляют надувной шарик, который пережимает ее, что заставляет легкие расти и расправляться — а во время родов шарик вынимают обратно. Эта техника оказалась куда эффективнее, и ее врачи используют до сих пор.
Кто право имеет
Внутриутробные операции увеличивают риски не только для ребенка, но и для матери. Без ее участия эта операция невозможна, и ей, как и ребенку, предстоит пережить наркоз, возможную кровопотерю и долгую реабилитацию — хотя она-то как раз может быть совершенно здорова. После первых операций Харрисона философы задумались: обязана ли она рисковать собственной жизнью и здоровьем, а также возможностью иметь новых детей (операция оставляет рубцы на матке, а это чревато бесплодием) ради неродившегося ребенка?
В этот момент споры вокруг технологии, которая могла бы хоть частично решить проблему абортов, становятся похожими на споры о самих абортах. Обязана ли мать сделать все от нее зависящее на благо ребенка, который еще не рожден?
К тому времени, когда развернулась эта дискуссия, в США уже появился закон об абортах — и суды признали право женщины на аборт по собственному желанию до определенного срока. А если за женщиной закреплено право на распоряжение собственным телом, то оно должно распространяться и на внутриутробные операции. Поэтому юристы сошлись на том, что едва ли кто-то сможет обязать женщину пойти на такую операцию, если она того не хочет.
Гораздо сложнее оказалось решить проблему с врачами: в случае, если что-то пойдет не так, можно ли обвинить их в смерти ребенка, который еще не родился? Граница, за которой врачей могли привлечь к ответственности, уже несколько раз двигалась. Когда-то все зависело от того, родился ли ребенок живым: если он продержался хотя бы несколько минут, ответственность за его здоровье ложилась на врача. Потом главным критерием стала жизнеспособность — врач начинал нести ответственность, если ребенок мог родиться живым хотя бы теоретически.
После операций Харрисона стало понятно, что границу нужно двигать снова. Теперь не только жизнеспособность, но и сам факт рождения стало сложно точно определить. Поэтому некоторые юристы предлагают ввести новую категорию людей — частично рожденные — чтобы отнести к ней тех, кого оперируют фетальные хирурги и установить для них отдельные законодательные нормы.
Окно возможностей
Пионеры внутриутробных операций оправдывали свои разработки тем, что на кону стояла жизнь ребенка — и то верили им не всегда. Еще сложнее пришлось тем, кто решил побороться не за жизнь, а за ее качество.
В 1997 году американские хирурги Тюлипан и Брюнер впервые прооперировали плод с диагнозом spina bifida (расщепление позвоночника). Это дефект развития спинного мозга, при котором часть нервной трубки, чаще всего на уровне крестца, остается открытой. Поэтому жидкость, которая омывает спинной и головной мозг, свободно вытекает в амниотическую полость. При этом развивающийся мозжечок часто смещается и блокирует отток спинномозговой жидкости из головного мозга, а ее скопление в желудочках приводит к гидроцефалии.
Spina bifida, как правило, не смертельна — младенцы обычно доживают до родов, после чего хирурги быстро заштопывают спинномозговой канал. Но последствия развития в таких условиях остаются на всю жизнь. В зависимости от того, какого размера и на каком уровне было отверстие и насколько сильно был поврежден головной мозг, могут возникнуть задержки в развитии. Некоторым детям приходится ставить шунт — трубку, которая проходит под кожей и выводит лишнюю жидкость из мозга в брюшную полость. А поскольку в районе отверстия может быть поврежден и спинной мозг, не каждый ребенок даже после операции может научиться ходить и контролировать мочеиспускание.
Тюлипан и Брюнер предположили, что этих осложнений можно избежать, если закрыть отверстие до родов и дать спинному мозгу срастись. Сначала они пытались оперировать с помощью фетоскопов, не внося в матку больших разрезов. Но это оказалось непросто — сквозь амниотическую жидкость было плохо видно сам дефект. Поэтому они перешли к открытым операциям: так же, как и Харрисон, делали надрез на животе женщины, доставали матку, делали разрез на матке и подтягивали к нему ребенка спиной кверху. После этого разделяли края спинной трубки на оболочки и сшивали их послойно: сначала внутренние, потом внешние. Операция оказалась вполне успешной.
К 1999 году у хирургов за спиной было уже несколько десятков внутриутробных пациентов. Многим из них операция помогла — например, герой фотографии «Рука надежды», Сэмюэл Армас, который хватался (или не хватался) за палец Брюнера, научился ходить без поддержки, хотя в баскетбол играл все-таки на коляске. Тюлипан и Брюнер подсчитали, что их метод снижает для ребенка риск гидроцефалии примерно с 91 до 59 процентов.
Но научное сообщество было настроено не столь оптимистично. В конце концов, потребность в шунтировании — не единственная и, возможно, не главная проблема, которой грозит spina bifida. Не менее важны способности ходить и контролировать мочевой пузырь — но чтобы выяснить, помогают ли с этим операции Тюлипана и Брюнера, нужно было подождать, пока их первые пациенты подрастут. На дальнейшие операции наложили временный мораторий — до результатов клинических испытаний. Из-за него без операции остался, в том числе, младший брат Сэмюэла Захарий, который тоже пострадал от spina bifida. Его оперировали уже после рождения, и, в отличие от старшего брата, самостоятельно ходить так и не начал.
Подозрения врачей были не беспочвенны. Дело в том, что многие внутриутробные пациенты после операции появляются на свет недоношенными. Любое вмешательство, и особенно разрезы, раздражают стенку матки и заставляют ее сокращаться. И хотя беременные женщины получают миорелаксанты в течение всей операции и продолжают принимать их все оставшееся время до родов, рожают они все равно раньше срока: на 36-й, 33-й или даже 30-й неделе из положенных 40. Так что их дети, вдобавок к тем рискам, которые несут с собой spina bifida, диафрагмальная грыжа и другие болезни, получают еще полный комплект рисков, связанных с недоношенностью: необходимость искусственной вентиляции, слабые кишечник и легкие и возможные задержки в развитии.
В случае с расщеплением позвоночника клиническое испытание завершилось успешно. Врачи подсчитали, что если ребенка оперировали внутриутробно, то шунтирование ему требуется реже, а двигательные навыки развиваются лучше, и такие дети чаще начинают самостоятельно ходить. Поэтому сейчас мораторий на внутриутробное лечение spina bifida уже не действует, и операцию постепенно осваивают в разных странах. Но список диагнозов, для которых такая операция возможна, пока не расширяется.
Риск преждевременных родов ограничивает интервал, в течение которого хирурги могут вмешаться во внутриутробную жизнь ребенка. Во время операции у матери может начаться кровотечение или сильное сокращение мышечных стенок матки — в этом случае операция превратится в экстренные роды. И если это произошло до 28-й недели беременности, то ребенок всерьез рискует не выжить или остаться больным. В то же время, для лечения многих болезней 28 недель — это уже слишком поздно, как в случае операций Харрисона, когда легкие детей были так сильно пережаты отекшими почками, что не смогли расправиться.
А это значит, что некоторые пороки развития, которые возникают на ранних стадиях и наносят непоправимый ущерб, исправить внутриутробно пока не получится. Заодно риск преждевременных родов в ближайшее время будет останавливать врачей и от того, чтобы пробовать свои силы на более мягких, не угрожающих жизни дефектах. Например, зашить расщепленную губу внутриутробно врачи решились только один раз. Операция прошла успешно, шрама не осталось — но младенец родился недоношенным и вскоре умер. Больше таких операций никто не проводил.
Дальше без скальпеля
Возможно, куда более плодотворная (и безопасная) идея — лечить детей, не разрезая матку. Кое-что врачи уж неплохо умеют. Например, подкармливать плод витаминами или гормонами щитовидной железы — если есть подозрение, что собственных ему не хватает — через кровоток матери или прямым уколом в амниотическую жидкость.
Можно было бы таким же способом снабжать ребенка и более сложно устроенными лекарствами. Так, еще с 1960-х годов врачи начали переливать внутриутробно эритроциты — в случае, если у ребенка резус-конфликт с матерью, и его собственные кровяные тельца погибают. А сейчас пробуют пересаживать и стволовые клетки: это безопаснее, чем у взрослых, потому что иммунитет ребенка работает слабее, и клетки легче приживаются. Стволовые клетки крови уже используют при комбинированном иммунодефиците — когда собственных иммунных клеток плоду не хватает. А мезенхимальные стволовые клетки пытаются приспособить для лечения миодистрофии (пока, правда, тщетно) и несовершенного остеогенеза (это получается лучше, но эффект оказывается временным, и после родов ребенку нужна бустерная доза клеток).
Повлиять одним уколом на развитие плода можно было бы и методами генной терапии. Редактировать зародыш целиком в мире пока запрещено, но чинить гены в отдельных тканях — по крайней мере, у взрослых — иногда вполне удается. Генную терапию внутриутробно врачи пока не применяли — сначала пытаются оценить возможные риски, проверяя ее на мышах или на новорожденных. У последних все пока проходит удачно — например, несколько лет назад трех младенцев удалось избавить от тяжелого комбинированного иммунодефицита.
Безусловно, не все пороки развития имеют генетическую природу. Но возможно, таких больше, чем кажется. Например, расщепленное нёбо оказалось связано с мутацией в конкретном гене, поэтому когда ученые просто вкололи беременным мышам в амниотическую полость вирусный вектор с работающей версией этого гена, их мышата родились здоровыми. А совсем недавно врачи описали новый генетический синдром у новорожденных — недоразвитые почки, позвоночник и умственная отсталость — и сразу же выяснили, что его можно внутриутробно предотвратить одним белком (пока, опять же, у мышей).
Так что, возможно, неизлечимых болезней и врожденных пороков со временем станет меньше. Впрочем, полностью избавиться от них невозможно. Всегда остаются какие-то болезни, вроде опухолей, от которых поможет только скальпель. Поэтому фетальные хирурги едва ли останутся без работы — и им всегда найдется, кому протянуть руку надежды.
Автор: Полина Лосева