Две работы, опубликованные в журнале Nature, посвящены новым достижениям, касающимся предотвращения рецидивов злокачественных опухолей путем иммунотерапии.
В первой работе американские ученые сообщают о положительных результатах первой фазы клинических испытаний вакцины с персонализированными неоантигенами против рецидивов меланомы. Во второй работе немецкие и австрийские онкологи также предотвращали рецидивы опухоли, но с помощью первой в своем роде вакцинации на основе РНК.
Меланома — злокачественная опухоль, развивающаяся из пигментных клеток кожи, у которых нарушаются механизмы деления и естественной клеточной смерти. Это одна из наиболее опасных опухолей человека. Для нее характерны рецидививы и метастазирование, при котором раковые клетки могут распространяться с током крови и лимфы по всему организму.
Совокупность генетических мутаций, приводящих к возникновению опухоли определенного типа, называется «мутаном» (по аналогии с совокупностью генов — геномом или совокупностью белков — протеомом). Мутаномы меланомы, известные на данный момент, составляют в среднем от одной до десяти мутаций.
Американские онкологи из института раковых исследований Дана-Фарбер, женской больницы Бригэма и Гарвардской медицинской школы в ходе работы с пациентами исследовали действие персонализированных вакцин, направленных на борьбу с меланомой. Вакцины разрабатывалась индивидуально для каждого пациента. Для этого ученые сначала секвенировали геном каждой опухоли и определяли ее мутаном. После этого они синтезировали соответствующие пептиды-антигены, представляющие участки белков, которые получаются в результате наличия в геноме таких мутации (в генах BRAS, NRAS и других), и которые иммунные клетки могут распознавать и уничтожать, если они знают, как именно они устроены. Пептиды в длину составляли от 15 до 30 аминокислот, каждому пациенту предназначалось 13-30 пептидов. При введении такой вакцины должны были активироваться Т-лимфоциты организма, создающие его иммунный ответ.
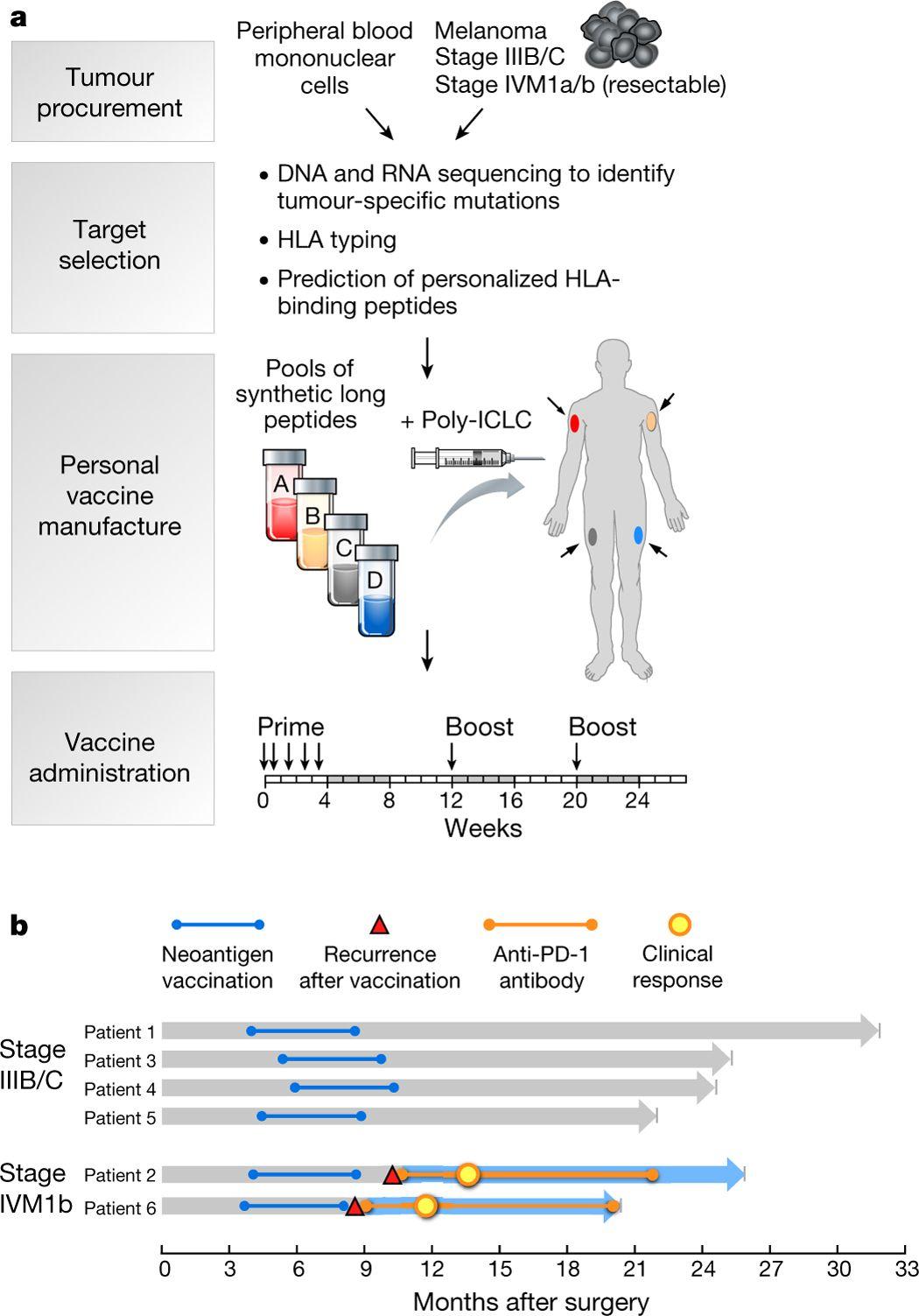
Исследования показали, что оба исследованных типа Т-лимфоцитов (CD4+ и CD8+ ) эффективно «обучались» и узнавали 60% и 16% из 97 использованных в работе уникальных антигенов, соответственно. Из шести пациентов, подвергнутых вакцинации после проведения операции по удалению опухоли, у четверых (со стадией меланомы IIIB/C) в течение 25 месяцев не было рецидивов. Двух других пациентов, у которых уже были метастазы в легких (стадия IVM1b), подвергли дополнительной терапии иммунологическим препаратом anti-PD-1 (anti-programmed cell death-1), после чего возникшие опухоли полностью регрессировали. Таким образом, первая фаза клинических испытаний этого проекта завершилась успешно.
Во второй публикации немецкие и австрийские онкологи сообщают о первом в своем роде применении персонализированных вакцин на основе РНК. Вместо синтеза пептидов, необходимых для «обучения» Т-лимфоцитов, ученые синтезировали РНК, которые кодировали эти пептиды, причем в этой работе было получено примерно на порядок больше разных неоантигенов. С их помощью также удалось добиться эффективного иммунный ответ Т-лимфоцитов, обучившихся борьбе с индивидуальными неоантигенами. У каждого пациента появлялись Т-лимфоциты, «знающие» по крайней мере три типа раковых мутаций своего организма.
У восьми из тринадцати пациентов с прооперированной меланомой не возникало рецидивов в течение 12-23 месяцев, в которые велись наблюдения. У двоих из оставшихся пяти пациентов метастазы возникли, но поддавались лечению на основе вакцинации (всего пациентам делали 20 введений вакцин), причем у одного из этих двоих метастазы полностью исчезли и не появились даже через 26 месяцев. Также ученые показали, что эффективность работы иммунологического препарата anti-PD-1, уже упомянутого выше, повышается в сочетании с такого рода вакцинацией.
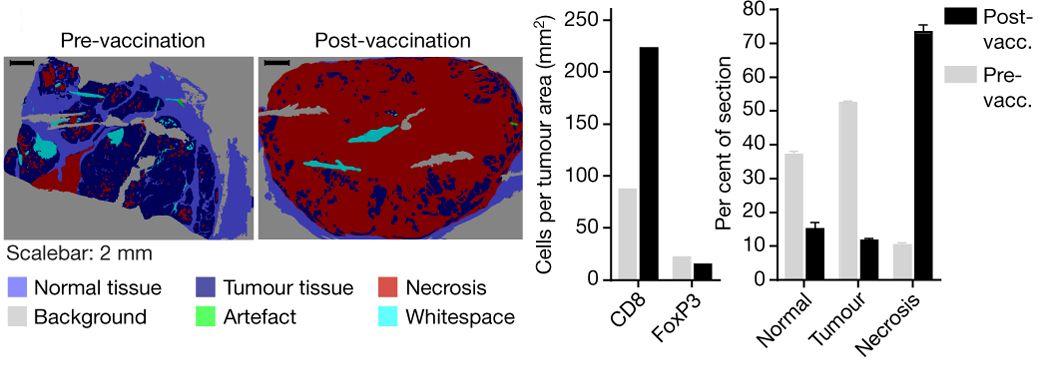
Оба исследования демонстрируют большие перспективы и безопасность применения антигенных вакцин для лечения меланомы. В будущем ученые собираются расширять область своих исследований, в том числе, чтобы охватить и другие типы рака.
А о сложностях введения иммунотерапевтических вакцин и о вариантах разрешения этих сложностей можно прочитать здесь.
Автор: Анна Казнадзей