Работая с человеческими антителами пациента, выжившего после лихорадки Эбола, американские исследователи обнаружили и подробно описали механизм их взаимодействия с участком вирусной оболочки.
Этот участок узнается не только у заирского вируса Эбола, но и у родственного ему вируса Бундибугио, что расширяет возможности применения будущей вакцины. Замена всего трех аминокислот в исходном антителе значительно повысила его эффективность и сделала его пригодным еще и для борьбы с суданским вирусом. Результаты опубликованы в журнале Nature Structural and Molecular Biology.
Эболавирусы вызывают массовые эпидемии в Африке, причем смертность при заражении может достигать 90 процентов. Они возникали и раньше, но особенное внимание к этой болезни появилось после ее вспышки в 2013-2016 годах, когда одна-единственная мутация поверхностного белка сделала вирус особенно агрессивным и привела к многочисленным смертям. Это произошло с заирским подтипом вируса, но другие подтипы могут аналогичным образом мутировать в ходе будущих эпидемий. Поэтому разработка какцины, которая годилась бы для всех подтипов сразу — важная мера для борьбы с Эболой.
Самые опасные штаммы объединяют в три группы, называющиеся по месту первого обнаружения: «классическая» заирская Эбола, суданская и Бундибугио. Симптомы у всех перечисленных болезней сходные — лихорадка, диарея, геморрой. Но несмотря на одно происхождение и сходство этих вирусов, общей вакцины для них не существует. В основе уже разработанных вакцин против заирской Эболы лежит использование гликопротеина, компонента клеточной стенки вируса. К сожалению, использовать его же в качестве мишени для других штаммов до сих пор получалось плохо из-за большой разницы между аминокислотными последовательностями.
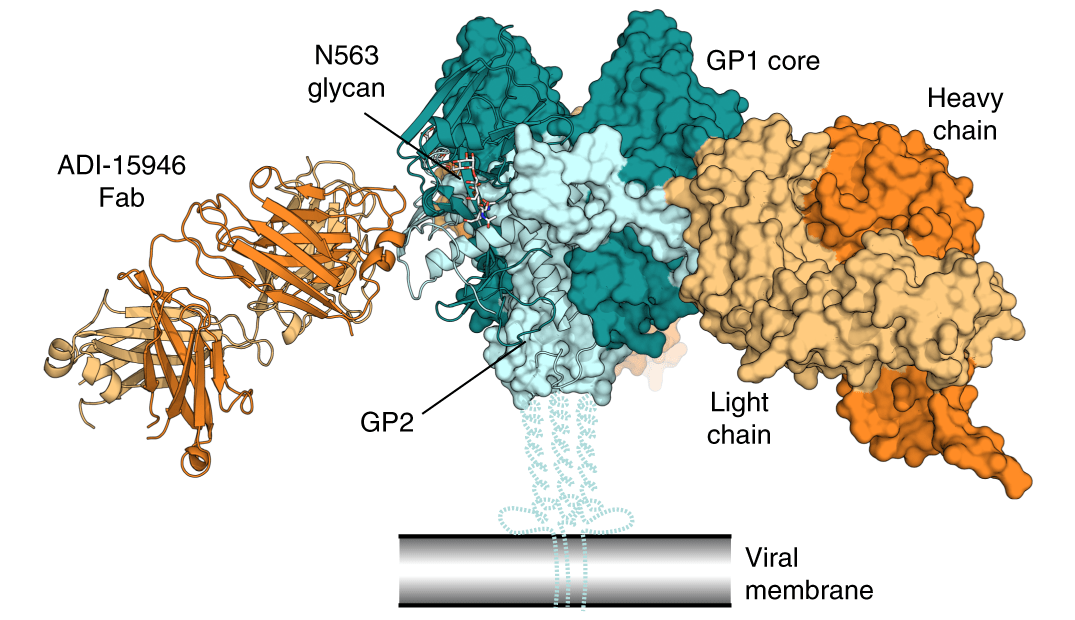
В ходе сборки предшественник гликопротеина разрезается на две части, GP1 и GP2, которые удерживаются между собой дисульфидным мостиком. GP1 довольно вариабелен, а GP2 консервативен, но спрятан под поверхностью вируса. Брандин Вест (Brandyn West) и его коллеги описали новые антитела ADI-15946 человека, переболевшего несколько лет назад заирской Эболой и посмотрели, с какими участками белка оно взаимодейтсвует. Для этого они определили кристаллическую структуру этого комплекса.
Оказалось, что антитело связывается с консервативным участком GP2 в гидрофобном кармане GP1, закрытом обычно участком гликановой шапочки. При проникновении вируса эта шапочка отрезается протеосомами хозяина, так что антитело способно взаимодействовать как внутриклеточной, так и с внеклеточной формой белка, но хуже из-за того, что ему мешает шапочка.
Исследователи сравнили связывание антитела с полноценным гликопротеином и без куска шапочки, и оказалось, что эффективность связывания последнего в 10000 раз выше. В предыдущих работах были обнаружены другие антитела FVM09, которые не мешают патогенам, но зато умеют «снимать» не очень важную для вируса гликановую шапочку. Совместная работа этих двух антител тоже повысила эффективность нейтрализации.
Тяжелые цепи вариабельного участка антитела ADI-15946 связываются с консервативным остатком лизина (K510) на участке GP2 и мутация в этом месте приводит к потере эффективности антитела. В целом оно хорошо работало против заирского штамма и Бундибугио, но было малоэффективно против суданского вируса. Чтобы понять, почему так происходит, исследователи сравнили поверхности с которыми соприкасается антитело у всех вирусов. В непосредственной близости от ключевого лизина оказался аспарагин (Asn506), который у суданского штамма был заменен на аргинин и с которым тоже взаимодействует участок антитела. Оказалось, что всего три мутации, одна на тяжелой цепи и две на легких позволили антителу эффективно бороться с суданским вирусом.
Кроме трех перечисленных типов эболавирусов известны еще два, не вызывающие серьезных эпидемий у людей. Недавно ученые нашли шестой тип, в первый раз обнаружив его не в заболевшем человеке, а в переносчике — летучей мыши.
Автор: Вера Мухина