После того как Нобелевский комитет два года подряд вручал премии по физиологии и медицине за сугубо фундаментальные разработки, на этот раз он, наконец, оправдал ожидания аналитиков и присудил премию за иммунотерапию рака. Приз разделят американский иммунолог Джеймс Эллисон и его японский коллега Тасуку Хондзё.

Выбор комитета никого не удивил — по крайней мере, имя Джеймса Эллисона последние несколько лет стабильно попадает в «шорт-лист» номинантов по мнению журналистов. В 2016 году агенство Clarivate Analytics, которое составляет прогноз на основе цитируемости работ ученых, включило его в свой список потенциальных лауреатов. Разработки Эллисона и Хондзё привели к появлению нового принципа лечения злокачественных опухолей, основанного на способности нашего собственного иммунитета распознавать и уничтожать раковые клетки.
Тормоза иммунитета
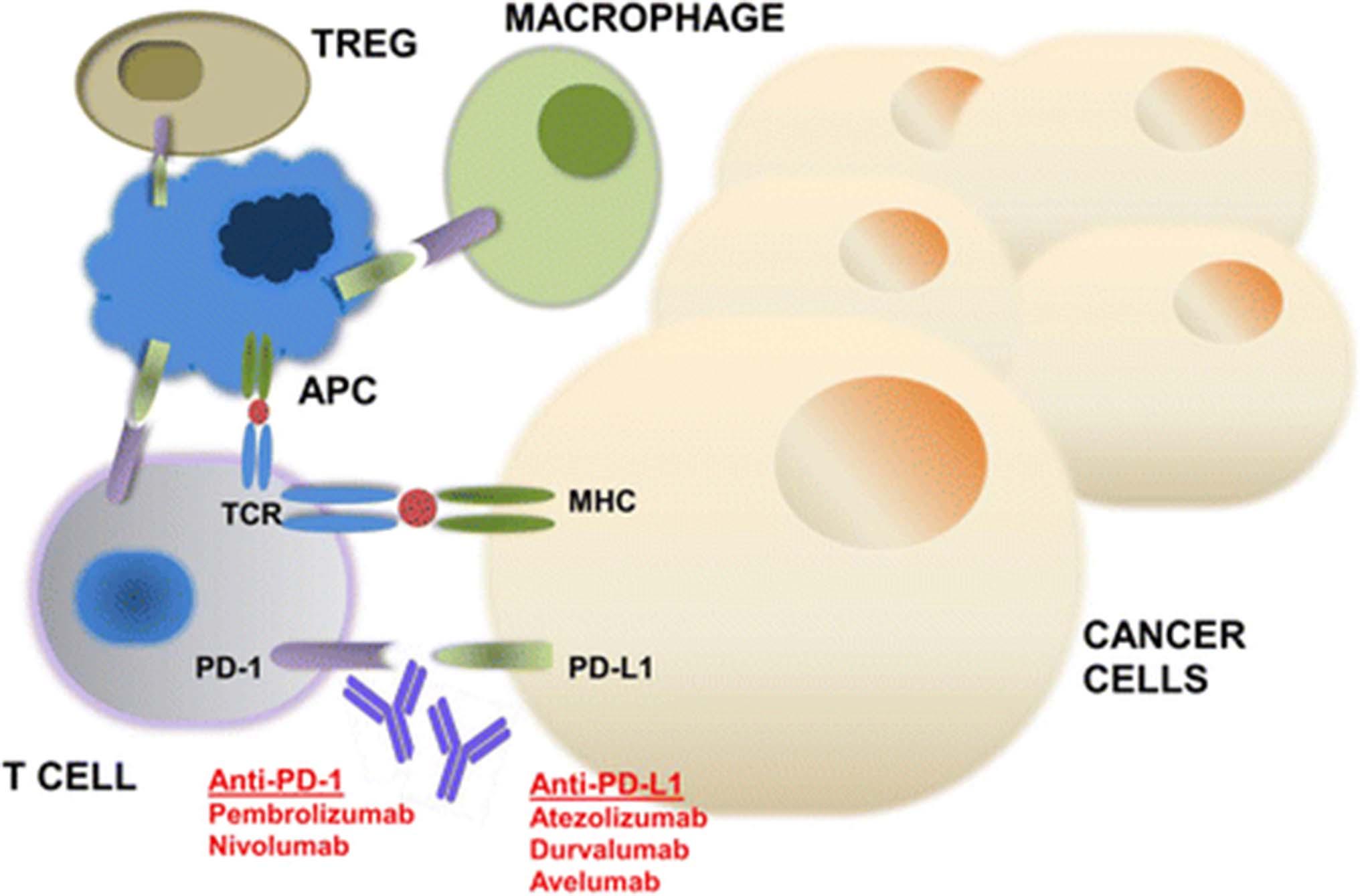
Работа клеток иммунитета, в данном случае — Т-лимфоцитов, балансирует на грани между «недоследить» и «перестараться». Для соблюдения баланса и предотвращения аутоиммунных заболеваний, когда лимфоциты начинают по ошибке атаковать нормальные клетки организма, у лимфоцитов есть «газ» и «тормоз». Это белковые рецепторы на поверхности клеток, связывание с которыми определенных молекул-лигандов либо активирует, либо подавляет деятельность иммунитета по уничтожению потенциальных «врагов». Обобщенно эти регуляторы называются точками контроля иммунитета, или «чекпойнтами». В каждую группу «чекпойнтов» (стимуляторов и ингибиторов иммунитета) входит более десятка молекул, но здесь мы рассмотрим две из них — CTLA-4 и PD-1. Обе эти молекулы являются «тормозами» иммунной системы.
Цитотоксичные Т-лимфоциты получают информацию о том, на что им нужно обратить внимание, от антиген-презентирующих клеток, которые «показывают» лимфоцитам фрагменты чужеродных белков. Чтобы активировать лимфоциты в отношении опухолевых клеток, антиген-презентирующая клетка должна связаться не только с Т-клеточным рецептором, но и с ко-стимуляторным рецептором CD-28. У CD-28 есть «злой брат-близнец» CTLA-4, взаимодействующий с тем же маркером, что и CD-28, но при этом, наоборот, подавляющий иммунный ответ — а именно, пролиферацию Т-клеток и продукцию сигнальных молекул, которые отвечают за реализацию иммунного ответа. Если «выключить» CTLA-4, у CD-28 не будет конкуренции и произойдет активация иммунитета.
Идея о том, что CTLA-4 выступает «тормозом» иммунитета, принадлежит, в том числе, Эллисону. В 1994 году сотрудники его лаборатории в Университете Калифорнии в Беркли занимались этим рецептором в поисках лекарства против аутоиммунных заболеваний. Однако у Эллисона появилась другая идея: вместо того, чтобы усиливать CTLA-4, он предложил заблокировать его при помощи специфичного антитела и таким образом активировать противоопухолевый иммунитет у мышей с карциномой. Подход сработал — введение антител затормозило рост опухолей у мышей. Кроме того, у вылечившихся мышей выработался иммунитет против данного вида рака – повторное введение злокачественных клеток не приводило к формированию опухоли. Статья с результатами эксперимента
Эти и подобные эксперименты по блокаде CTLA-4 вызвали интерес в индустрии, и несколько лет спустя подход был опробован на человеке. В 2011 году американское управление по контролю за продуктами и лекарствами одобрило первый медицинский препарат, направленный на терапию злокачественной меланомы путем ингибирования иммунного «чекпойнта» — ипилимумаб (моноклональное антитело, связывающееся с рецептором и не дающее ему работать). Пока это единственный одобренный препарат, работающий именно с CTLA-4.
За эту работу Эллисон был удостоен множества наград — среди них и премия Ласкера, самая престижная после Нобелевской в области медицины, и приз Национального фонда исследования рака, и награды от различных фармацевтических компаний. Можно сказать, что Эллисон с 2011 года ежегодно получал какую-нибудь премию, так что эта череда закончилась Нобелем вполне закономерно.
Второй «рычаг» иммунитета — PD-1 — дошел до клиники позже, хотя был открыт несколькими годами ранее. Эта заслуга принадлежит сотруднику Киотского университета в Японии Тасуку Хондзё. Он и его коллеги идентифицировали ген PD-1, выяснили, что соответствующий белок принадлежит к суперсемейству иммуноглобулинов, и показали, что он каким-то образом связан с клеточной смертью на модели опухолевых клеток. Тот факт, что PD-1 играет роль негативного регулятора иммунитета, был установлен только в 2000 году. Кроме того, в этой работе был обнаружен партнер (лиганд) PD-1 – белок, который так и назвали, PD-L1 (ligand of PD-1). Было обнаружено, что раковые клетки нередко продуцируют много белка PD-L1 на своей поверхности. Идея, что блокировка как PD-1, так и PD-L1 может привести к активации противоопухолевого иммунитета, была подтверждена на мышах в публикации 2005 года.
Уже в 2006 году было запущено первое клиническое испытание на людях, однако первый анти-PD-1 препарат ниволумаб был одобрен для лечения рака только в 2014 году. Одновременно был одобрен и второй препарат — пембролизумаб от компании Merck. Среди типов рака, против которых действуют анти-PD-1 антитела, — прогрессирующая меланома, немелкоклеточный рак легкого, почечная карцинома, лимфома Ходжкина и другие.
Что изменилось в лечении рака
До недавнего времени терапия рака базировалась на трех основных принципах — хирургическом вмешательстве, облучении опухоли радиацией и противоопухолевой химиотерапии, целью которой является относительно неспецифичное, за редкими исключениями, уничтожение быстро делящихся опухолевых клеток токсичными веществами. Однако уже в начале XX века ученые поняли, что опухолевые клетки — такая же мишень иммунитета, как бактерии и паразиты, и предприняли первые попытки лечить опухоли активацией иммунитета. Тем не менее, от идеи противоракового иммунитета в какой-то момент отказались. Открытия, сделанные в лабораториях Эллисона и Хондзё, в корне изменили это представление, и терапия «ингибиторами чекпойнтов», в особенности антителами против PD-1 и PD-L1, сейчас находится на переднем крае медицины.
«В клинической онкологии это одно из крупнейших событий в истории», — говорит заместитель генерального директора Национального исследовательского центра детской гематологии, онкологии и иммунологии имени Димы Рогачева Михаил Масчан. «Мы сейчас только начинаем пожинать плоды, которые принесла разработка этого типа терапии. Сейчас зарегистрировано пять (на самом деле шесть) препаратов этой группы, и в разработке находятся десятки, если не сотни молекул, эксплуатирующие этот принцип».
Чем же отличаются эти препараты от более традиционных методов лечения? Как показали первые результаты клинических испытаний на пациентах с агрессивной формой меланомы, терапия первым одобренным «чекпойнт-ингибитором» увеличила выживаемость пациентов в полтора раза по сравнению со стандартной химиотерапией. Кроме того, иммунотерапия назначается пациентам в тех случаях, когда стандартный курс химиотерапии не помог или болезнь вернулась. К примеру, среди разновидностей рака, для лечения которых одобрен пембролизумаб, — метастазирующий рак легкого, а также рецидивирующий рак головы и шеи. Многим пациентам с такими диагнозами химиотерапия не помогает.
«Дело в том, что у больных с распространенными опухолями, особенно с меланомой, сейчас с помощью комбинации этих чекпойнт-ингибиторов долгосрочная выживаемость, то есть фактически выздоровление, может быть достигнута в 30-40 процентах случаев. При некоторых других опухолях тоже очень сильно улучшается результат», — комментирует Михаил Масчан. «Это самое начало пути, но мы знаем уже много видов опухолей — и рак легкого, и меланома, и ряд других, при которых терапия показала эффективность, но еще больше — при которых она только исследуется, исследуются ее комбинации с обычными видами терапии. Число людей, которые выжили благодаря этой терапии, измеряется десятками тысяч».
Не панацея
К сожалению, несмотря на многообещающие результаты, терапия «чекпойнт-ингибиторами» помогает не всем. К примеру, белок PD-L1 экспрессируется раковыми клетками не у всех людей, потому направленная против него иммунотерапия не сработает, если белка нет. Есть данные, что такой вид терапии лучше помогает пациентам, у которых по тем или иным причинам повышена вероятность возникновения мутаций в ДНК, в том числе, под действием табачного дыма или радиации. К примеру, уже упомянутый пембролизумаб рекомендован в качестве терапии неоперируемых или метастазирующих опухолей у пациентов с нарушениями репарации ДНК. Это первый случай в терапии рака, когда препарат рекомендован для лечения опухоли только на основании наличия определенных мутаций, вне зависимости от типа опухоли.
«Рак — это сотни, если не тысячи разных болезней, и у каждой свои механизмы и молекулярные пути, которые при этом работают, и никто не придумает одного лекарства, эффективного при всех видах рака у всех пациентов. Но эти лекарства помогают при разных типах опухолей, потому что они действуют не на уровне индивидуальных процессов в опухолевой клетке, а на уровне иммунной системы», — комментирует Масчан.
Кроме того, терапия не лишена побочных эффектов. В первую очередь, это аутоиммунные реакции, ведь препараты вызывают активацию иммунитета, «спускают собак с цепи», по выражению Михаила Масчана. Лечение «чекпойнт-ингибиторами» может привести к развитию воспаления самых разных органов. Кроме того, препараты хорошо работают на взрослых людях, но не работают на детях. Наконец, лечение пока еще очень и очень дорого стоит.
«Эта революция в основном коснулась взрослой онкологии, в детской онкологии такой революции эти исследования не сделали, потому что детские опухоли биологически устроены иначе, иммунная система их видит очень плохо, — объясняет Масчан. — В России официально разрешены к применению три лекарства этой группы. Но, к сожалению, цена одного курса этой терапии довольно высокая, она измеряется десятками тысяч долларов в год. Впрочем, российские биофармацевтические компании работают над созданием отечественных вариантов этих лекарств, и есть вероятность, что в ближайшем будущем они появятся на рынке по более низким ценам. Я думаю, что этого можно ждать уже через год — два».
Автор: Дарья Спасская