Впервые термин «буллезный эпидермолиз» употребил еще в 1886 году немецкий дерматолог Генрих Кёбнер. Болезнь не назвали в его честь (хотя он оставил о себе память в истории медицины в виде феномена Кёбнера или реакции Кёбнера – поражения кожи в виде длинных линий в области травмы).
Буллезный эпидермолиз – это группа врожденных генетических заболеваний, при которых даже незначительное механическое воздействие приводит к образованию на коже и слизистых оболочках пузырей. Когда эти пузыри разрываются, на их месте остаются болезненные и быстро инфицирующиеся раны, с трудом поддающиеся лечению.
Болезнь сильно ограничивает жизнь страдающих от неё людей и требует сложного и дорогостоящего ухода за пациентами. Нередко проявления заболевания выражены настолько, что больные неспособны себя обслуживать и полностью зависят от своих близких. Недаром их часто называют «детьми-бабочками» или «детьми с хрустальной кожей».
Кожа человека состоит из нескольких слоев клеток – кератиноцитов. Они соединяются и удерживаются вместе с помощью специальных белков – в основном это кератины, коллаген, ламинин и киндлин. При буллезном эпидермолизе в генах, необходимых для их синтеза, происходят мутации. В результате структура и функции этих белков нарушаются. Это приводит к тому, что даже при небольшом давлении или натяжении кожи её слои отходят друг от друга и в этом месте образуются пузыри.
Несмотря на то, что основные проявления болезни связаны с кожей, болезнь затрагивает весь организм, значительно снижая качество жизни человека – от ротовой полости до нервной системы. Наиболее часто из внекожных проявлений болезни встречаются поражения слизистых оболочек желудочно-кишечного тракта.
В ротовой полости образуются эрозии и пузыри, в пищеводе со временем образуются сужения, значительно затрудняющие глотание. Кроме того, нередки случаи нарушения проходимости кишечника, анальных трещин и запоров. К поражениям глаз относятся хроническое воспаление, образование эрозий и язв на роговице, иногда приводящим к формированию сращений со слизистой оболочкой века. Чрезвычайно сильно ограничивает способность к самообслуживаню сращение пальцев в единый кожный кокон. Ещё одна немаловажная опасность для людей, страдающих буллезным эпидермолизом — повышенный риск рака кожи, увеличивающийся с возрастом больного.
Сложно точно сказать, насколько эта болезнь распространена. По данным национального реестра США, заболеваемость составляет 1,11 случаев на 100 тыс. в популяции и 1,96 на 100 тысяч новорожденных. В России, по оценкам фонда «Дети-бабочки», который помогает детям с буллезным эпидермолизом, сейчас насчитывается около 2000-2500 человек (или 1,73 случая на 100 тысяч), страдающих этим недугом.
Лечение
Лечение буллезного эпидермолиза до недавних пор заключалось только в ведении образа жизни, уменьшающего вероятность травмирования кожи и использовании специальных дорогостоящих повязок. Однако уже давно у врачей и исследователей появилось желание воздействовать на причину заболевания – неспособность клеток плотно соединяться друг с другом.
Начиная с конца восьмидесятых годов предпринимались разные попытки лечения, основанные на методах клеточной терапии. Их целью было улучшить течение болезни в тех ситуациях, когда обычное лечение не помогало. Однако в большинстве случаев эффект был выражен слабо и длился очень недолго.
Первым подходом клеточной терапии была попытка трансплантации пациентам с этим недугом кератиноцитов, которые были взяты из непораженных участков кожи. Это давало ограниченный и непродолжительный эффект, который, по-видимому, был обусловлен временным уменьшением воспаления в зоне трансплантации.
Другой подход основывался на внутривенном введении стволовых клеток костного мозга и так называемых мезенхимальных стромальных клеток (МСК), способных мигрировать в зоны повреждения. Исследователи предполагали, что эти клетки, взятые у здоровых доноров, смогут синтезировать нормальные белки, необходимые для образования здоровой кожи. Однако, как и в предыдущем случае, эффект этого лечения был успешным лишь отчасти.
При использовании стволовых клеток костного мозга наблюдалось временное улучшение течения болезни. Однако несколько пациентов в течение клинического исследования умерли от осложнений, связанных с подготовкой к трансплантации. В случае использования МСК столь драматичных побочных эффектов не было. Но эффект от лечения, заключавшийся в ускорении заживления ран и улучшении общего самочувствия, по-прежнему длился не более полугода.
Из-за сложностей, связанных с получением стволовых клеток костного мозга и МСК, ученые обсуждают возможность использования так называемых индуцированных плюрипотентных стволовых клеток (ИПСК), за создание которых японский исследователь Синья Яманака в 2012 году был удостоен Нобелевской премии. ИПСК это обыкновенные сформировавшиеся клетки организма, которым в лаборатории «обратили время вспять» — снова сделали их стволовыми, дали им возможность превращаться почти в любые клетки организма. В том числе — в стволовые клетки костного мозга, МСК или сразу в фибробласт или кератиноцит.
Однако процесс получения клеток из ИПСК пока технически несовершенен, поэтому исследования таких клеток проводятся пока только в условиях лабораторий.
На первый взгляд может сложиться впечатление, что введение стволовых клеток костного мозга и МСК в кровь пациента малоперспективно из-за технического несовершенства этого подхода и кратковременности терапевтического эффекта. Тем не менее дальнейшие исследования в этом направлении необходимы, потому что на сегодняшний день это — единственный подход, потенциально позволяющий действовать на внекожные проявления болезни.
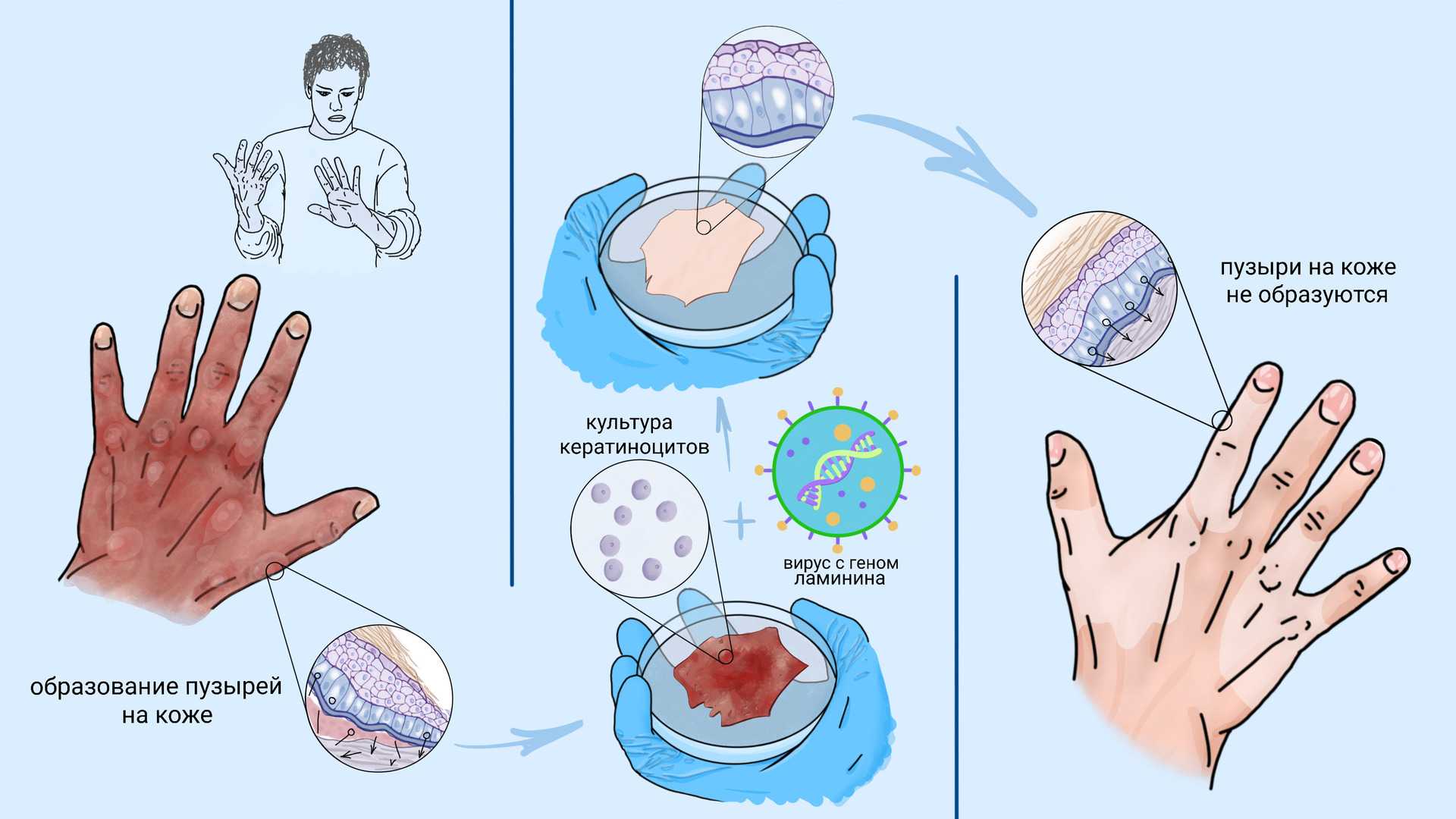
Об первом успехе генно-клеточной терапии буллезного эпидермолиза стало возможным говорить в 2006 году, когда исследовательская группа итальянских врачей и ученых смогла восстановить кожу пациента с пограничным эпидермолизом. Эта форма заболевания появляется при мутации в гене белка ламинина.
Для лечения пациента исследователи выделили из неповрежденных участков его кожи кератиноциты, в которые ввели здоровый ген ламинина. Далее в лабораторных условиях получили из этих кератиноцитов вырастили тонкие пласты ткани, которые трансплантировали в поврежденные участки кожи. Через полгода после трансплантации кожа в зоне трансплантации не отличалась от нормальной и не требовала повторных вмешательств.
Успех этого подхода закрепил опыт 2015 года по трансплантации практически всего эпидермиса семилетнему мальчику, утратившему к моменту первой трансплантации около 80% кожных покровов. В результате лечения у пациента сформировалась полностью здоровая и функциональная кожа. Сейчас, спустя пять лет после лечения, трансплантированная кожа пациента почти не отличается от здоровой. Он ведет обычную жизнь и даже занимается спортом, несмотря на то, что до лечения из-за боли практически не мог двигаться и нормально питаться и нуждался в постоянном использовании морфина. На сегодняшний день эта технология используется в трех препаратах, проходящих клинические исследования – EB-101, LZRSE-Col7A1 и FCX-007.
Еще один препарат, проходящий клинические исследования — B-VEC. Его преимуществом является возможность непосредственного введения в кожу пациентов, что позволяет исключить затратный по времени этап выделения и культивирования клеток пациента.
Начальные этапы исследований ведутся ещё для двух препаратов, механизм действия которых отличен от описанного ранее. В первом случае это PTR-01, представляющий собой искусственно полученный коллаген VII типа. Его разработчики предполагают введение препарата внутривенно, поскольку ожидают системного действия, позволяющего воздействовать не только на кожу, но также на слизистые оболочки и другие затронутые болезнью органы.
Обсуждается также ряд подходов, основанных на молекулярных методах геномного редактирования. К ним относятся метод РНК-интерференции, редактирование генома системой CRISPR/Cas9, антисмысловые нуклеотиды. Однако на сегодняшний день исследования этих методов ограничиваются лабораторными испытаниями, поэтому обсуждать их терапевтическую эффективность пока преждевременно.
Текст: Федор Индейкин