Китайским исследователям удалось успешно исправить мутацию в гене бета-глобина человеческих эмбрионов, приводящую к развитию анемии.
В качестве инструмента для редактирования генома ученые применили «редактор оснований», разработанный на основе системы CRISPR/Cas9. С его помощью удалось направленно внести в геном однонуклеотидную замену в четверти случаев. Исследование было опубликовано в журнале Protein & Cell, также о нем рассказывается в редакционной статье журнала Nature.
Мутации в генах, кодирующих цепи гемоглобина, являются причиной развития талассемии — анемии, вызванной нарушением синтеза гемоглобина. Однонуклеотидная замена аденина на гуанин в регуляторной области гена HBB (HBB −28 A>G), кодирующего бета-глобин, входит в тройку самых распространенных причин бета-талассемии в Китае и Юго-Восточной Азии. Эта мутация приводит к снижению экспрессии гена HBB и, как следствие, к гемоглобиновой недостаточности у ее носителя.
Китайским исследователям из университета Сунь Ятсена удалось исправить эту мутацию в человеческих эмбрионах, превратив G обратно в A при помощи нового инструмента редактирования генома на базе CRISPR/Cas9. Эффективность редактирования составила 40 процентов на уровне эмбрионов и 23 процента на уровне отдельных клеток.
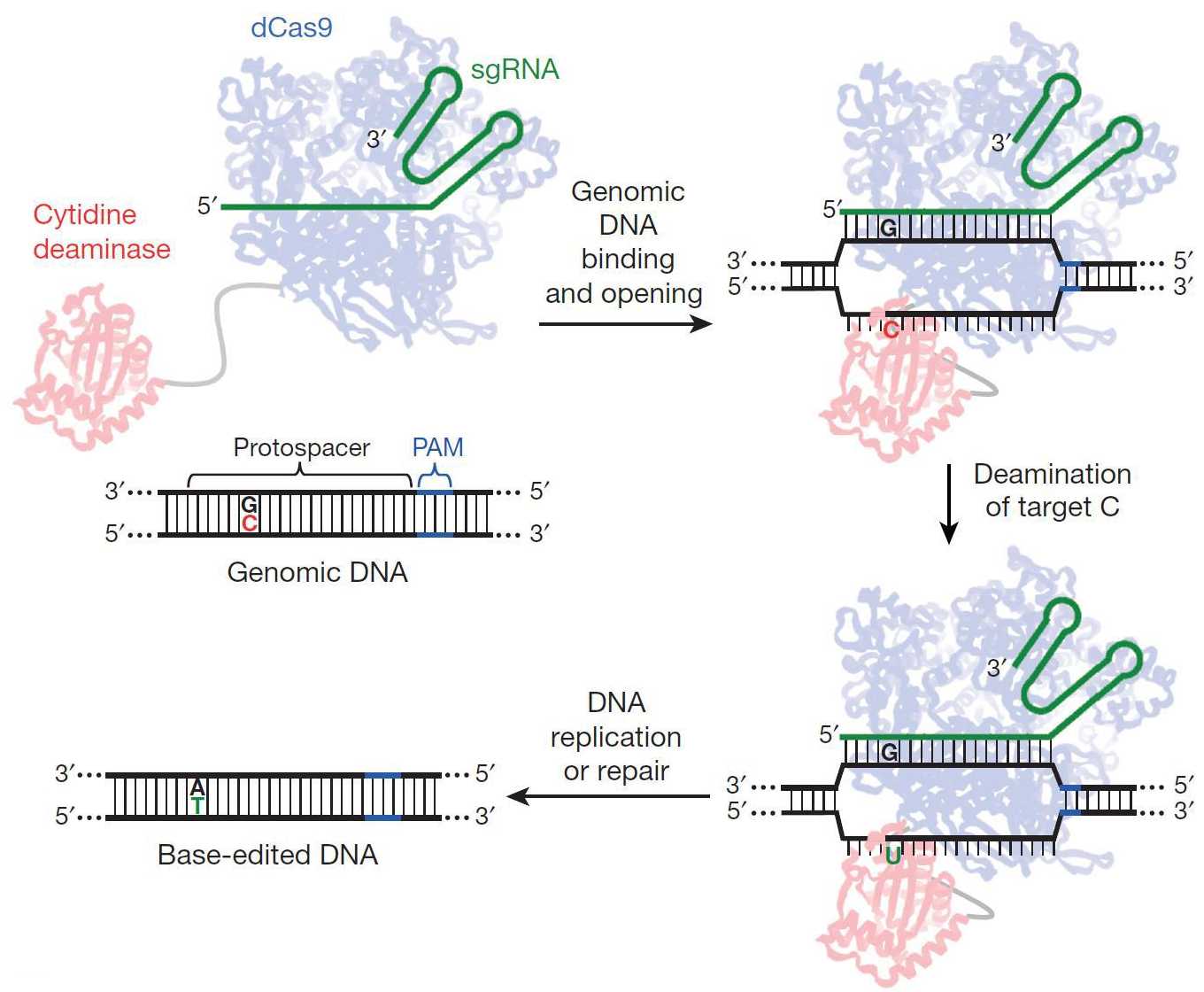
В новой системе, получившей название «редактор оснований» (base editor) (с публикацией, посвященной разработке этого метода, можно ознакомиться здесь), используется каталитически неактивный белок dCas9, неспособный разрезать ДНК. Такой белок в комплексе с направляющей РНК служит средством доставки пришитого к нему «рабочего» домена к определенной последовательности в ДНК.
Рабочей частью в «редакторе» служит фермент цитозин деаминаза, которая «отрывает» аминогруппу от цитозина, оставляя на его месте урацил. В результате в ДНК образуется «неправильная» пара U:G (урацил напротив гуанина), которая распознается системой репарации неспаренных оснований. Дополнительная модификация метода позволила добиться того, что в цепи репарируется именно G. Это приводит к образованию «правильной» пары U:A, которая после раунда репликации превращается в T:A. Схема метода представлена ниже, а освежить в памяти принцип работы исходного белка Cas9 можно здесь.
Немногим ранее другая исследовательская группа продемонстрировала, что этот метод применим в трипронуклеарных зиготах («бракованных» эмбрионах, полученных путем искусственного оплодотворения, содержащих тройной набор хромосом). В новой работе исследователям требовались эмбрионы, содержащие мутацию HBB −28 (A>G) в двух копиях. Такие эмбрионы были получены путем клонирования — слияния соматической клетки пациента с талассемией с безъядерной яйцеклеткой.
Вскоре после слияния исследователи вводили в полученные одноклеточные эмбрионы мРНК «редактора» и направляющую РНК для него. Через 48 часов, после того, как развивающиеся эмбрионы успевали пройти три-четыре деления, авторы анализировали, прошло ли редактирование. Анализ проводился путем секвенирования участка с мутацией, которую нужно было исправить, и десяти дополнительных сайтов, куда потенциально мог бы привлечься «редактор».
В первом эксперименте анализ суммарной ДНК 22 эмбрионов показал, что в 9 случаях редактирование прошло правильно, и G заменилась на A. Еще в одном G заменилась на С. Таким образом, успешное редактирование прошло в 40 процентах эмбрионов.
Во втором эксперименте эффективность редактирования оценивали на уровне отдельных клеток эмбрионов. В этом случае доля успеха составила 11 из 48, при этом в восьми случаях редактирование прошло по обеим цепям, то есть исправились обе копии гена HBB. Однако такое несовпадение результата на уровне отдельных клеток и на уровне эмбрионов напрямую указывает на то, что все исследуемые эмбрионы получились «мозаиками». Это означает, что после редактирования в разных клетках одного и того же эмбриона генотип отличается. Мозаичность эмбрионов на сегодняшний день — одна из основных и нерешенных проблем редактирования людей.
Та же исследовательская группа два года назад опубликовала пионерскую работу, посвященную редактированию генома человеческих эмбрионов, о чем можно прочитать здесь. В прошлой работе ученые пытались исправить мутацию в гене HBB при помощи «канонической» системы CRISPR/Cas9 с использованием гомологичной рекомбинации для внесения замены в ДНК. Однако эффективность редактирования оказалась очень низкой — оно прошло только в четырех случаях для 54 исследованных эмбрионов.
Множество исследований на клетках человека с тех пор подтвердили, что при помощи Cas9 ген легко «сломать», но очень сложно «починить». Использование неактивного Cas9 как средства доставки других белков значительно расширило возможности этой системы. К примеру, мы писали, что «пришивка» к dCas9 РНКазы позволила использовать систему CRISPR/Cas9 для удаления нежелательных РНК.
Автор: Дарья Спасская