Первый из них открыл способ обратить клеточное время вспять — и получил за это Нобелевскую премию. Второй придумал, как это время точно измерить. Третий и четвертый показали, что можно продлить жизнь трансгенным мышам, омолаживая их клетки.
Рассказываем, на кого сделали ставку Джефф Безос и Юрий Мильнер, создав корпорацию для разработки лекарства от старости — и какую задачу на самом деле будет решать нанятая ими звездная команда.
Американский журнал MIT Technology Review выяснил, что Джефф Безос и Юрий Мильнер (через благотворительный фонд, который он учредил со своей женой Юлией) и, возможно, другие крупные инвесторы основали компанию Altos Labs, которая будет заниматься изучением старения. Издание сообщает, что ведущим исследователям новорожденной компании обещаны не меньше миллиона долларов в год и свобода научного поиска. При этом никакой четкой цели — вроде создания конкретного препарата или выхода на клинические испытания — пока не заявлено. Основатели не планируют в ближайшее время получить с нее прибыль.
Это не первая громкая инвестиция американских магнатов в науку о старении. В предыдущий раз подобное произошло в 2013 году, когда корпорация Google запустила компанию Calico Labs. Та тоже не обещала скорых прикладных результатов — только внимательное и разностороннее исследование проблемы. Этих результатов, действительно, нет и до сих пор.
Один из источников MIT Technology Review сообщает: первым продуктом работы Altos Labs должна стать «хорошая наука». Но, в отличие от Calico Labs, эта наука будет сосредоточена на одном-единственном из потенциальных методов продления жизни. Исследователи из Великобритании, Японии и США, классики геронтологии и нобелевские лауреаты будут решать конкретную задачу: как открутить назад возраст отдельных клеток, не навредив здоровью их хозяина.
Вверх по склону
В середине ХХ века английский эмбриолог Конрад Уоддингтон предложил читателям своей монографии представить себе горстку мраморных шариков, которые катятся с высокой горы.
Такой метафорой Уоддингтон описывал события, которые происходят с отдельными клетками внутри развивающегося зародыша. Клетки стартуют с вершины — неспециализированного состояния, которое само по себе неустойчиво, и катятся на равнину, в стабильное состояние окончательной дифференцировки. Время от времени на пути каждого шарика попадается холм, который образует развилку: стукаясь об него, шарик соскальзывает в «правую» или «левую» ложбину — и в зависимости от этого клетка вступает на тот или другой путь дифференцировки.
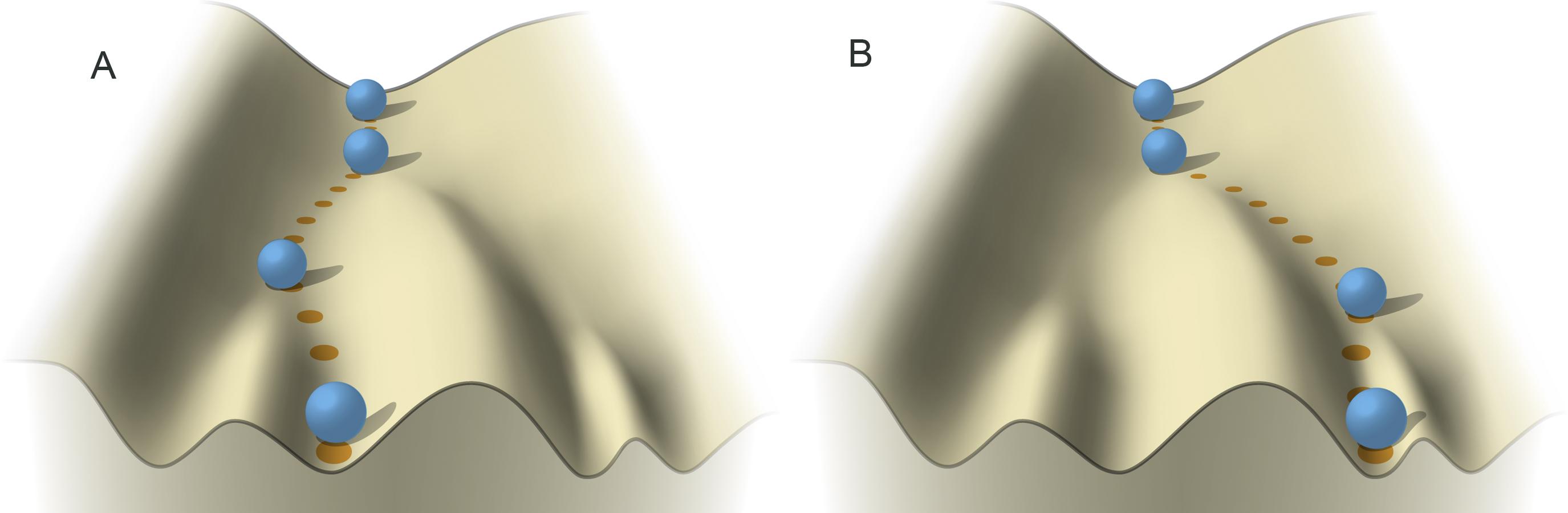
Модель Уоддингтона была именно что метафорой: он пытался описать принцип, по которому клетки выбирают свою судьбу — и что закрывает им дорогу назад. Ученый не ставил своей целью объяснить, как именно на клеточном уровне выглядит конкретная развилка — да и сделать это ему было бы непросто: когда он впервые заговорил о своем ландшафте, до появления уотсон-криковской модели ДНК оставалось еще 14 лет. Это сейчас мы понимаем, что ложбинам и плато соответствуют метки на ДНК (эпигенетические маркеры), которые заставляют участки ее нитей скручиваться или раскручиваться, тем самым запрещая или разрешая работу находящихся там генов. Поэтому, чтобы закатить шарик вверх по склону уоддингтоновского ландшафта, надо поработать с сотнями химических бирок на генах: где-то добавить, где-то убрать.
В 2006 году это удалось японским ученым Яманаке и Такахаши: они превратили клетки кожи в неспециализированные — подобные тем, из которых состоит зародыш в первые дни развития. Для этого японцам понадобились всего четыре белка (их потом назовут «коктейлем Яманаки»): Oct4, c-Myc, Sox2 и Klf4. Под их действием многие участки ДНК развернулись, обнажив гены, к которым клетки кожи давно потеряли доступ. Оказалось, что этого достаточно, чтобы сделать их стволовыми — и потом вырастить из них любые типы клеток взрослого организма.
Так Яманака и Такахаши открыли источник универсальных человеческих запчастей, и некоторым ученым показалось, что проблема старения почти решена — хватило бы только времени и денег. Например, сторонник «инженерного» подхода к старению Обри ди Грей предложил решить таким образом проблему изнашивания органов: выращивать их в лаборатории из стволовых клеток и заменять ими те, что не удалось спасти другими методами.
Но даже сейчас, когда Яманака уже девять лет как нобелевский лауреат, Япония усеяна клиниками стволовых клеток, а ученые научились выращивать из репрограммированных клеток яйцеклетки и нейроны, рассчитывать на искусственные органы пока рано.
Тому есть несколько причин. Во-первых, выращивать ткани все еще сложно и дорого. Во-вторых, далеко не все части человеческого тела ученые до сих пор смогли собрать in vitro. Если с полыми органами, вроде трахеи или мочевого пузыря, справиться относительно легко, то воспроизвести сложную трехмерную структуру печени или почки еще никому не удалось. В-третьих, репрограммированные клетки на поверку оказались довольно опасными: подобно эмбриональным, они легко разрастаются в опухоли. Поэтому пока их используют в основном для относительно изолированных органов типа глаз или имплантируют в капсулах, чтобы они не могли расползтись по организму.
Закатить шарик на вершину горы оказалось недостаточно. Теперь нужно научиться управлять его спуском.
Без стариков
В модели Уоддингтона путешествие клеток-шариков по горным склонам заканчивалось на плато дифференцированного состояния. Поскольку ученого интересовало в первую очередь развитие организма, он не заботился тем, что происходит с клетками потом. Сейчас мы знаем, что на дифференцировке их путь не заканчивается: получившие профессию клетки могут скатиться еще ниже — в состояние, где они не делятся, не выполняют своих обязанностей и живут в дефиците энергии. Это называют сенесцентностью, или клеточной старостью.
Столкнуть клетку в ущелье старости можно разными способами. Иногда это происходит само собой — например, если клетка накопит достаточно мутаций в своих генах. Иногда ее подталкивают соседи — другие постаревшие клетки. Иногда клетка резко стареет из-за стресса вроде сильного воспаления или отравления ядом. Так или иначе, чем дольше существует ткань, тем больше клеток в ней начинают катиться в эту сторону, цепляя по дороге соседей.
Можно представить себе, что жизнь человека станет сильно лучше (а там, глядишь, и дольше), если убрать сенесцентные клетки из его тканей. У нас даже для этого есть инструмент — препараты-сенолитики. По крайней мере, пожилых мышей они избавляют от проблем с позвоночником и некоторых когнитивных нарушений.
В надежде, что и для людей сенолитики окажутся небесполезны, Джефф Безос пять лет назад сделал свою предыдущую инвестицию в науку о старении — компанию Unity Biotechnology. Компания запустила сразу несколько клинических испытаний сенолитиков, на пациентах с болезнями коленей и нарушением зрения. Но заметных результатов пока получить не удалось. На уровне ткани препараты работают, а легче пациентам не становится.
Почему людям сенолитики помогают меньше, чем мышам, пока неясно. Может быть, исследователи просто не подобрали нужное сочетание и дозу, и успех еще впереди. А может быть, ошибочна сама стратегия. Все клетки со временем медленно катятся с вершины недифференцированной молодости в каньон сенесцентности, и отстреливая тех, кто в него уже свалился, сенолитики не облегчают участь тех, кто стоит на краю пропасти. Технология, на которую Безос делает ставку в этот раз, должна работать иначе — двигать все клетки организма вверх по склону эпигенетического ландшафта и отдалять наступление старости для каждой из них по отдельности. И здесь могут пригодиться четыре белка из коктейля Яманаки.
Чтобы убедиться в том, что репрограммирование действительно может отодвинуть клетки от края бездны, нужно уметь довольно точно измерять, насколько они к ней близки — то есть вычислять внутренний возраст клетки. Это стало возможно в 2013 году, когда американец Стив Хорват сконструировал первые «эпигенетические часы»: составил список эпигенетических меток на ДНК, по наличию или отсутствию которых можно определить, насколько клетка близка к эмбриональной стволовой или к сенесцентной.
Таким образом, уже почти десять лет в руках у геронтологов есть два ключевых инструмента для омоложения клеток. Известно, чем толкать шарик в гору. Есть чем измерить свой прогресс. А вот что до сих пор неизвестно — и эту задачу, безусловно, придется решать сотрудникам Altos Labs — это как остановить шарик в нужной точке.
В будущее поведут они
Конрад Уоддингтон предполагал, что клетки в организме могут двигаться по эпигенетическому ландшафту лишь в одну сторону: сверху вниз. Сейчас мы научились отодвигать их от пропасти, возвращать на вершину и даже перебрасывать из одной ложбины в другую (это называют трансдифференцировкой). Все это неплохо выглядит в пробирке на отдельных клетках, но для живого организма может стать смертельным экспериментом.
В 2013 же году группа биологов под руководством испанца Мануэля Серрано приступила к репрограммированию клеток in vivo. Они создали линию мышей, у которых гены, соответствующие четырем белкам Яманаки, находились в зоне действия специального регуляторного участка — а тот, в свою очередь, реагировал на присутствие антибиотика доксициклина. Таким образом, когда мышам добавили в питьевую воду доксициклин, в их клетках — везде, куда препарат мог добраться с током крови — началось репрограммирование.
Группа Серрано добилась своего: в теле мышей появились клетки, аналогичные эмбриональным. Но ни о каком продлении жизни не было и речи — по всему организму животных начали расти опухоли, и особенно часто почему-то в поджелудочной железе и почках. Это, с одной стороны, доказывало, что методика работает, а с другой — что в таком виде она неприменима ни к мышам, ни тем более к людям.
Через несколько лет другой испанский биолог, Хуан Карлос Исписуа Бельмонте, разработал более щадящий вариант того же метода. Его исследовательская группа тоже вырастила трансгенных мышей, но поила их доксициклином с перерывами — чтобы белки Яманаки не работали постоянно. В итоге удалось подобрать такой режим, при котором мыши действительно прожили дольше. Правда, в этом эксперименте участвовала специальная линия преждевременно стареющих мышей.
У обычных пожилых грызунов с помощью этого же метода удалось заставить мышечную ткань регенерировать. А вот стали ли они сами жить дольше, исследователи почему-то не проверили.
Но и эту технологию невозможно напрямую перенести на людей — для этого их пришлось бы генетически модифицировать. А значит, нужно найти способ доставлять коктейль Яманаки в клетки извне. Такой способ придумали совсем недавно: группа ученых (в состав которой вошел в том числе Стив Хорват) ввела в глаз мышам аденовирусные векторы, несущие в себе гены белков Яманаки. Конструкция тоже включалась в ответ на доксициклин, и это позволило улучшить зрение пожилых мышей и научить старые нейроны отращивать аксоны после травмы. Эпигенетический возраст обработанных нейронов снизился, дифференцировки они при этом не потеряли (то есть так и остались нейронами) — и ни одной опухоли у грызунов не возникло.
В список сотрудников Altos Labs, по сведениям MIT Technology Review, вошли все, кто сделал эту технологию возможной: и Яманака, и Хорват, и Серрано, и Бельмонте. Кроме того, отбирать проекты, которые получат финансирование компании, позвали Дженнифер Дудну, которая недавно получила Нобелевскую премию за изобретение, CRISPR-редактирования генома (об этом подробнее читайте в материале «Запомните эти буквы»). Это может означать, что у создателей компании есть свой план по поводу того, как регулировать работу белков Яманаки в клетках. С помощью модифицированной системы CRISPR/Cas можно не только разрезать ДНК, но и включать или выключать работу генов — к этому тоже, кстати, приложил руку Бельмонте — и это в перспективе может оказаться безопаснее, чем кормить людей доксициклином.
Altos Labs — далеко не первая компания, которая специализируется на репрограммировании клеток. На этом поле уже играет подразделение Calico Labs, а также несколько более мелких компаний — например, Turn Biotechnologies, AgeX и Genecure. Правда, ни одна из них не может похвастаться таким звездным составом. Зато многие из них обозначили свои цели — скромные, но конкретные. Так, Genecure собирается точечно омолаживать колени, AgeX целится в сердце, а Turn Biotechnologies интересуют суставы и мышцы, и все они медленно подбираются к клиническим испытаниям своих препаратов.
Цель, которую себе поставили учредители Altos Labs, выглядит намного амбициознее. Как они предполагают к ней идти, остается только гадать. Зато уже можно представить себе, какие задачи на этом пути придется решить отцам клеточного репрограммирования: дотянуться до глубоко запрятанных тканей, заставить их клетки помолодеть — и научиться останавливать этот процесс, пока не стало слишком поздно.
И как бы ни выглядело их решение, уже понятно, что процедура не будет ни легкой, ни однократной. Клетки нельзя омолаживать постоянно, нужно время от времени давать им передышку и возможность повзрослеть обратно.
Мифический царь древнего Коринфа попробовал было сбежать из загробного мира — и за это был приговорен богами вечно катить камень в гору. Коллективному Сизифу из Altos Labs предстоит закатить в эпигенетическую гору триллионы камней-клеток одновременно — ровно потому, что это, кажется, и есть один из самых перспективных способов отложить приближение смерти. Один из инвесторов Altos Labs, 57-летний Джефф Безос, не так давно рискнул стать первым пассажиром космического корабля, который построила его компания. Планируют ли они вместе с 59-летним Мильнером первыми испытать на себе репрограммирование, мы пока не знаем.
Автор: Полина Лосева
