Небольшие генетические модификации клетки помогают запускать нужный ген простым «выключателем», связанным с обычной батарейкой. После внесения таких клеток в страдающих диабетом мышей те смогли менять уровень инсулина и сахара в крови без всяких уколов.
Швейцарские ученые смогли внести в клетки человека генетические модификации, благодаря которым определенные гены стало возможно избирательно включать с помощью слабого тока. Концепцию удалось подтвердить и в экспериментах на животных, запуская у них производство инсулина простым нажатием переключателя. Авторы, статья которых опубликована в журнале Nature Metabolism, надеются, что их разработка поможет в создании медицинских имплантов для генной терапии.
В самом деле, сегодня врачи и пациенты сплошь и рядом прибегают к использованию компактных электронных имплантов, которые помогают отслеживать сердцебиение или уровень глюкозы в крови. Устройства, активно корректирующие состояние организма, встречаются намного реже, и до сих пор нет ни одного, которое помогало бы в генной терапии — новейшем подходе к лечению болезней за счет внесения точечных изменений в геном соматических определенных клеток.
Проблема в том, что генетика и электроника — вещи крайне далекие друг от друга, и регуляция активности генов производится биохимическими сигналами и инструментами. Восполнить пробел между ними может концепт, разработанный командой Мартина Фуссенеггера (Martin Fussenegger) из Швейцарской высшей технической школы Цюриха (ETH Zurich), — методика, которую авторы назвали DART (DC-Actuated Regulation Technology, «Технология регуляции (генов) постоянным током»).
Система опирается на тот факт, что слабый ток приносит в клетку свободные электроны, что, в свою очередь, приводит к увеличению концентрации реактивных форм кислорода (ROS), таких как пероксид. В клетке уже есть целый набор белков, способных служить естественными детекторами таких радикалов, включая KEAP1, который участвует в подавлении опухолей. Заметив накопление реактивного кислорода, KEAP1 высвобождает сигнальный протеин NRF2, тот проникает в клеточное ядро и запускает ряд антиоксидантных и противоспалительных механизмов.
Первые эксперименты показали, что слабый (4,5 вольта) постоянный ток не создает достаточно ROS, чтобы активировать систему KEAP1/NRF2. Поэтому ученые модифицировали клетки, внеся в них дополнительные гены KEAP1/NRF2, а также изменив промоторы — участки ДНК, запускающие работу того или иного гена — на которые воздействует NRF2. Такие клетки «в пробирке» уже реагировали на действие тока, включая ген инсулина, который управлялся соответствующими промоторами.
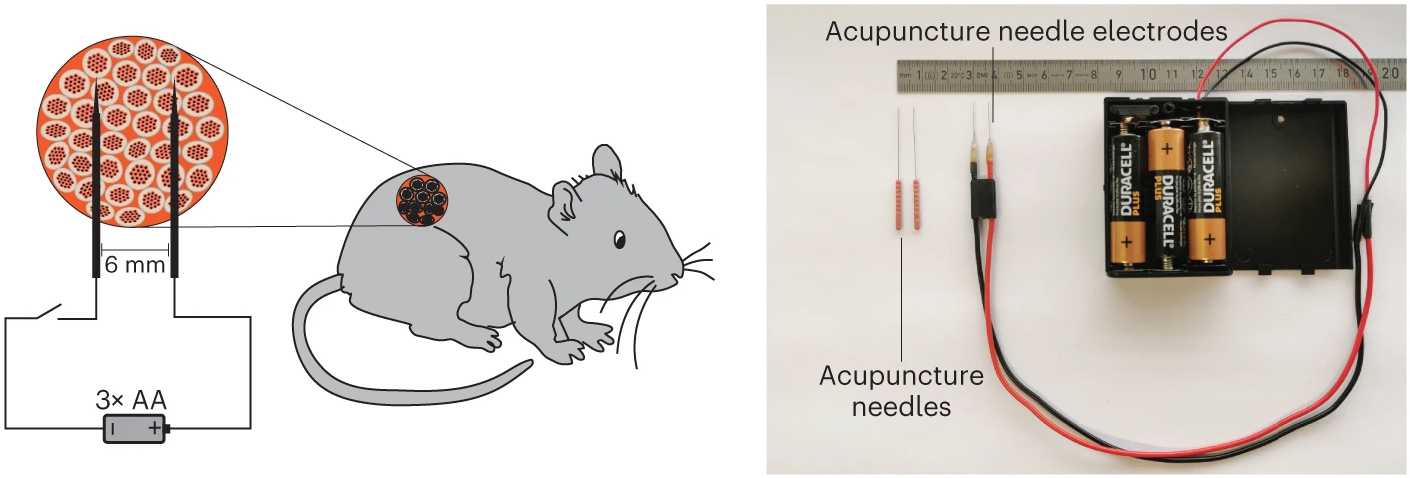
Работоспособность технологии DART подтвердили и следующие опыты на лабораторных животных. Ученые взяли модельную линию мышей, предназначенных для исследований диабета первого типа, поместили производящие инсулин ГМ-клетки в капсулы и внесли их в организм грызунов. Клетки стимулировали электрическим током разной силы и продолжительности, отслеживая концентрацию глюкозы в крови животных.
В итоге исследователи обнаружили, что синтез инсулина (а в результате и уровень сахара, который контролирует этот гормон) коррелировал с силой и временем включения «генно-электрического» интерфейса DART. Фактически несколько таких включений производили эффект, аналогичный нескольким уколам инсулина в сутки, которые требуются сегодня многим больным диабетом. Возможно, в будущем генная терапия, дополненная DART-имплантами, избавит их от этой мучительной процедуры. Достаточно будет датчика глюкозы, ГМ-клеток и обычной батарейки, которая «включит» их гены электричеством.
Автор: Сергей Васильев