Американские исследователи, которые разрабатывают подходы к исправлению мутаций в гене дистрофина при помощи CRISPR, описали еще одну эффективную систему возобновления синтеза этого белка в мышцах модельных животных.
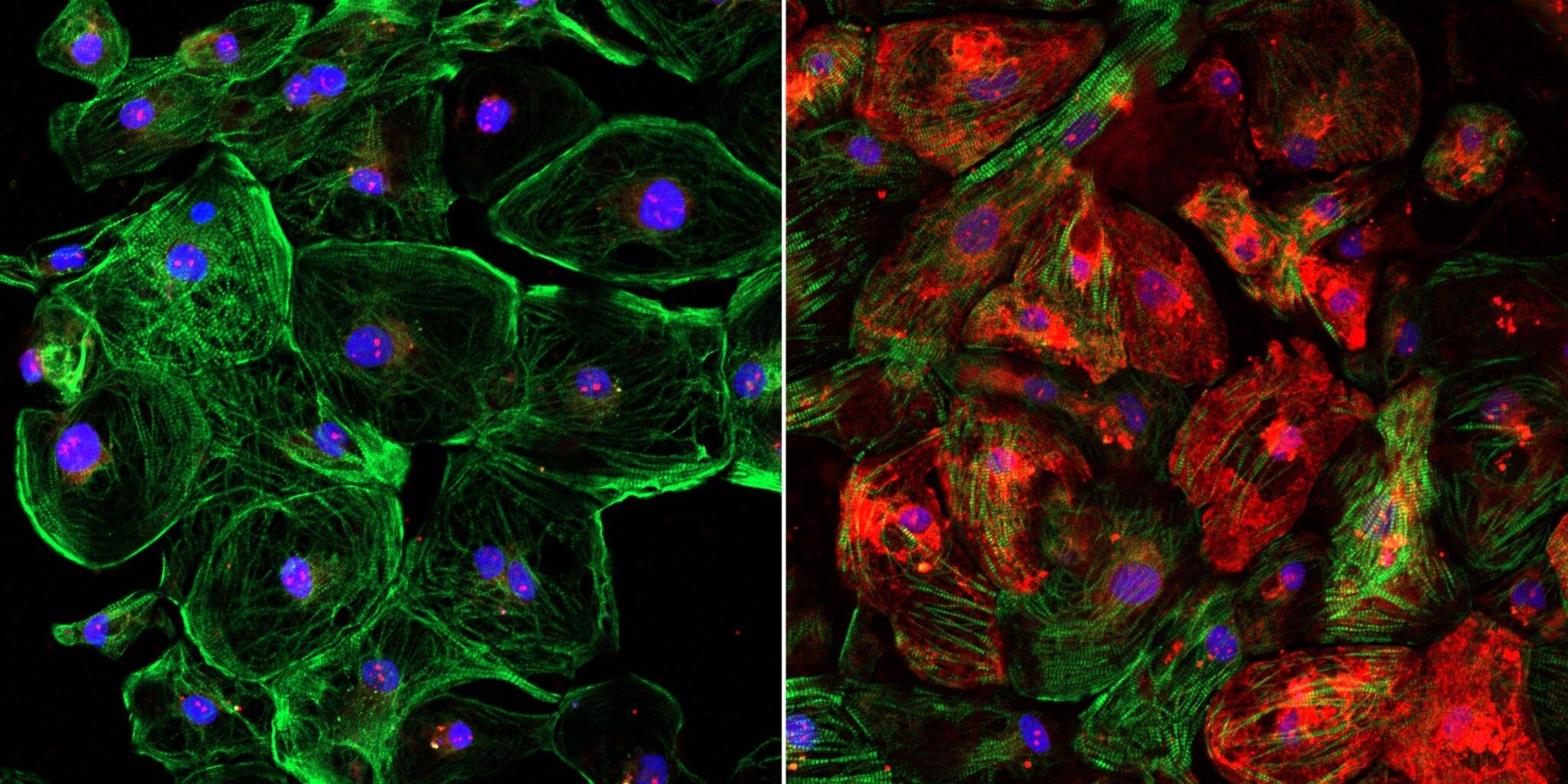
Для этого ученые разработали новую мышиную модель миодистрофии Дюшенна. Как сообщается в статье в Science Advances, экспрессия дистрофина в мышцах экспериментальных мышей достигла 90 процентов от нормы.
Нарушение синтеза белка дистрофина в результате врожденной мутации приводит к развитию прогрессирующей с возрастом миодистрофии Дюшенна, которая ведет к смерти больного в возрасте 20–30 лет. Вредные мутации встречаются в среднем у одного из 3600 мальчиков.
Ген дистрофина имеет сложную структуру и состоит из множества кодирующих кусочков — экзонов. Делеции в нескольких из них приводят к появлению в гене стоп-кодона и синтеза укороченного нефункционального белка. Исследователи выяснили, что восстановить синтез рабочей версии дистрофина можно, удалив кусочек с мутацией при помощи так называемого «пропуска экзонов» (exon skipping). Так как края экзонов содержат участки узнавания для белка Cas9 (PAM), вырезать мутантные экзоны достаточно удобно при помощи системы CRISPR-Cas9. О том, как это работает, мы уже рассказывали в другой заметке.
Исследователи из университета Техаса под руководством Эрика Олсена (Eric Olson) ранее опробовали подход с CRISPR для вырезания 51 экзона в гене дистрофина для устранения мутации, которая обуславливает 13 процентов случаев заболевания. В новой работе ученые сосредоточились на другом типе мутации — делеции в 44 экзоне гена. Эта мутация отвечает за 12 процентов миодистрофии Дюшенна у людей.
В предыдущем случае у ученых была возможность проверить систему на собаках породы бигль, у которых встречаются случаи миодистрофии из-за общей с людьми мутации. Однако на этот раз для проверки эффективности удаления 44 экзона авторам работы пришлось создать новую модель миодистрофии и вывести мышей с соответствующей делецией в геноме. Дистрофин в мышцах модельных животных не детектировался.
Подбор направляющей РНК для вырезания 44 экзона осуществляли на стволовых клетках, взятых у пациента с миодистрофией Дюшенна. Из отредактированных клеток затем выращивали клетки сердечной мышцы. Ученым удалось подобрать эффективную направляющую РНК на участок гена, который совпадает у мыши и у человека. Направляющую РНК и ген белка Cas9 вводили мышам в составе отдельных вирусных векторов. Как и раньше, ученые использовали аденоассоциированный вирус серотипа 9 (AAV9), который имеет наибольшее сродство к мышцам. Кроме того, экспрессия CRISPR-Cas9 была ограничена тканеспецифичными регуляторными элементами.
Вирусные частицы вводили животным в мышцу либо в кровь. Оказалось, что при системной доставке (через кровь) экспрессия рабочей формы дистрофина в сердце достигает 80 процентов от нормы. Когда же концентрацию вектора, содержащего ген направляющей РНК, повысили в 10 раз, количество дистрофина в сердечной мышце составило уже 90 процентов от нормы. Из этого эксперимента исследователи сделали важный вывод, что количество направляющей РНК влияет на экспрессию Cas9 и лимитирует эффективность редактирования.
Несмотря на высокую эффективность терапии, полученную на мышах, ученые признают, что для человека она может быть гораздо меньше, так как человек гораздо больше мыши и эффективность редактирования будет ограничиваться уже эффективностью вирусной доставки. Для единственного одобренного на сегодняшний день препарата, действие которого основано на том же принципе пропуска экзонов (этеплирсен), эффективность вырезания составляет менее одного процента.
Вспомнить, как работает система редактирования CRISPR-Cas9, можно в материале «Увидеть CRISPR своими глазами».
Автор: Дарья Спасская