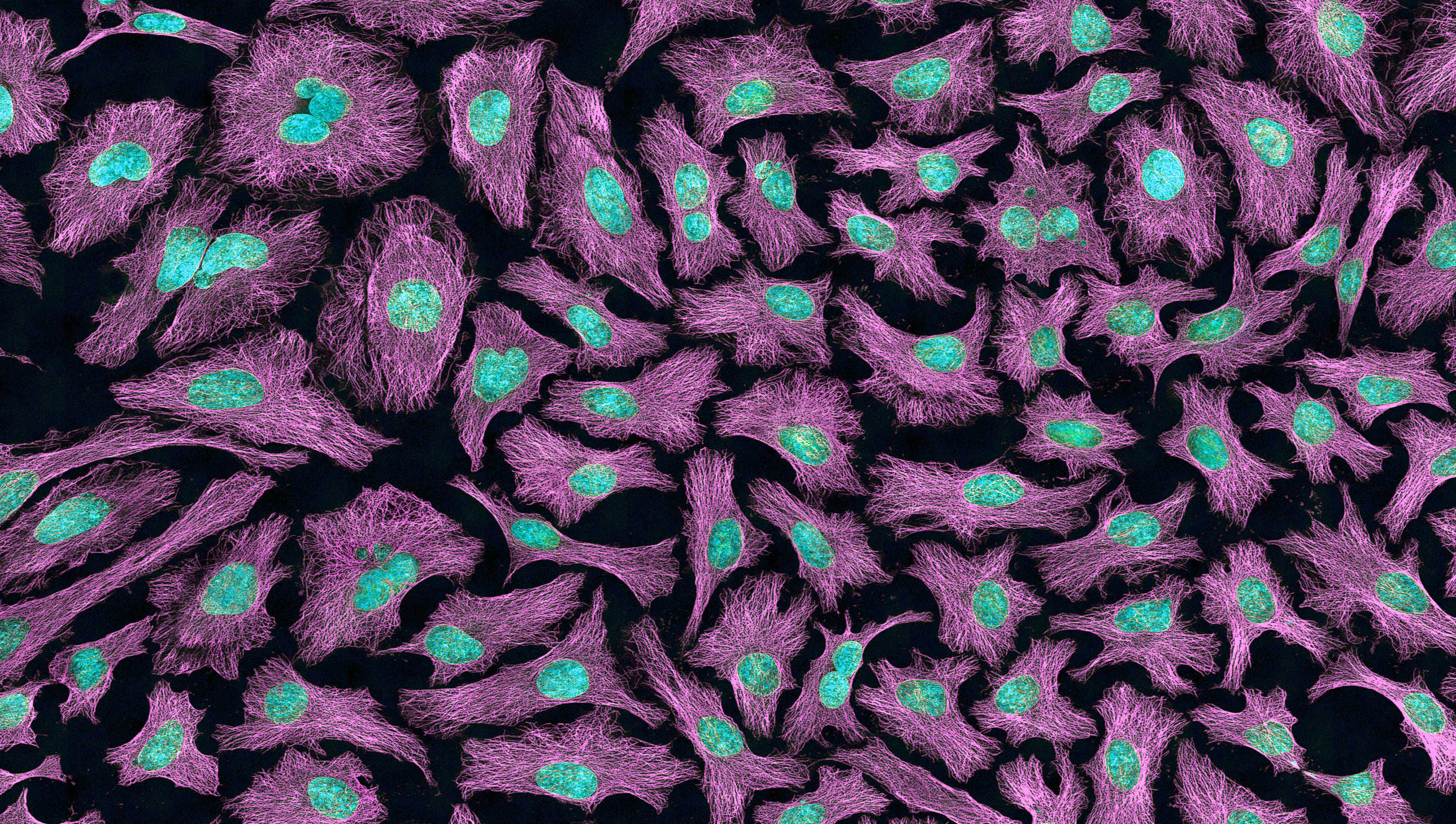
Генриетта Лакс скончалась 4 октября 1951 года от опухоли шейки матки. 4 октября 2021 года ее внуки подали в суд на фармкомпанию, которая продает клетки этой опухоли — культуру HeLa. Рассказываем, как сложилась их жизнь после смерти хозяйки, где они успели побывать, кого убить — а кого спасти.
Журналисты на 23 процента реже пишут о статьях, в заголовках которых фигурируют мыши, — подобные исследования, мол, не так важны и серьезны, как эксперименты с людьми. Но попробуйте только представить себе мир, в котором лабораторных мышей не существует. Каждый эксперимент в таком мире длится не дольше пары лет (мышиная жизнь коротка), а о репрезентативных выборках и речи не идет: подопытными становятся ровно те мыши которых экспериментатору удалось поймать в ближайшем подвале — молодые и старые, больные и здоровые.
Именно так обстояли дела в биотехнологиях до 1951 года.
Большинство клеток человека просто отказывались размножаться в неволе: в лучшем случае они выживали при переезде на чашку Петри — но там уже постепенно умирали. Единственные клетки, которые хоть как-то приспособились к жизни в лаборатории, были эмбриональными, их получали из тканей мертворожденных детей или зародышей после аборта. Они, по крайней мере, умирали не сразу, и вирусологи выращивали в них человеческие полиовирусы.
Но любые клетки — что взрослые, что зародышевые — приходилось каждый раз ловить и одомашнивать заново. Каждая лаборатория держала свое немногочисленное клеточное стадо и не рисковала делиться им с коллегами. А без общего стандарта невозможно воспроизводить чужие результаты, и уж тем более объединять усилия — например, для поиска новых лекарств.
Что именно не устраивало человеческие клетки в культуре, толком никто не понимал. Это сейчас у нас есть инструкции о том, как заботиться о каждом типе ткани: чем кормить (сахар, сыворотка крови, незаменимые аминокислоты, гормоны, витамины, антибиотики), куда поселить (температура, влажность, кислород в воздухе), на что сажать (стекло, пластик, биополимерные подложки), когда менять жидкость и как часто пересаживать с чашки на чашку. Сто лет назад гистологи тыкались наугад, пытаясь подобрать сколько-нибудь приемлемые для клеток условия, — но за первые полвека в этом так и не преуспели.
Чтобы освоить искусство культивирования, нужно было найти неприхотливые клетки, которые согласятся терпеть дискомфорт и эксперименты над собой. Лучше всего на эту роль подходили клетки опухолей: они гораздо менее привередливы, чем обычные и неохотно умирают — что позволяет им выигрывать конкуренцию внутри человеческих тканей. Одомашнить опухоль ученые пытались еще с 1910-х годов. Но первым этого добился биолог из больницы Джонса Хопкинса. Его звали Джордж Гай.
Как приручить клетку
Гай оказался в этой роли не случайно. Как пишет журналистка Ребекка Склут в книге «Бессмертная жизнь Генриетты Лакс», ученый хотел найти лекарство от рака и потому несколько десятилетий потратил на то, чтобы научиться выращивать опухолевые клетки в культуре. Его лаборантка кормила их свежей кровью (за которой приходилось ездить то на скотобойню, то в роддом). Его жена, бывшая хирургическая медсестра, вымуштровала сотрудников дезинфицировать все поверхности в лаборатории. А сам Гай из подручных средств построил для клеток вращающийся инкубатор: чем-то похожий на бетономешалку, он делал буквально пару оборотов в час — и, по замыслу создателя, должен был имитировать медленный ток крови в человеческой ткани.
Но клетки все равно умирали. Какие-то перегревались, какие-то не могли смириться с лабораторной диетой, а какие-то вытесняли из культуры залетные бактерии. Некоторые клетки, правда, умудрялись удержаться на плаву (в буквальном смысле слова — они росли не на подложке, а в растворе): культура-рекордсмен прожила в лаборатории Гая около пяти лет. Правда, в ней не осталось тех клеток, которые он, собственно, пытался вырастить — они умерли еще в самом начале эксперимента от перегрева, уступив дорогу своим соседям по ткани.
В начале 1950-х Гай полностью переключился на рак шейки матки: коллега по больнице хотел проверить одну свою гипотезу в отношении этой опухоли и потому начал снабжать Гая образцами ткани от всех своих пациенток. 8 февраля 1951 года он передал образец, извлеченный из тела молодой афроамериканки Генриетты Лакс. Пробирку, как это было тогда принято, подписали по первым буквами имени: HeLa.
Через несколько дней лаборантка Гая заметила, что клеток в пробирке стало вдвое больше. Потом еще больше, и еще. Впервые опухолевые клетки не только не умерли — они оказались чистой культурой без примесей и делились каждые сутки. HeLa не перестали расти ни через месяц, ни через два. Они еще далеко не побили рекорд предыдущей опухолевой культуры, но Гай уже догадался, что к нему в руки попал уникальный объект, — и назвал их бессмертными.
Это эпидемия
Остальные клетки Генриетты Лакс оказались не такими живучими. Одновременно с образцом опухоли хирург вырезал из шейки матки участок здоровой ткани, но его обитатели в инкубаторе Гая не прижились. В теле Генриетты они тоже вскоре начали проигрывать. После того, как врачи взяли образцы ткани, они ввели в шейку матки трубку с радием — так в то время выглядела лучевая терапия — но это не помогло. Как вспоминал потом лечащий врач Генриетты, «с клинической точки зрения, дела у нее никогда не шли хорошо». После терапии опухоль не увяла, как обычно, а продолжила разрастаться, захватывая другие внутренние органы, — в то время, как вторая ее половина обживала инкубатор доктора Гая. Они росли параллельно еще несколько месяцев, пока в конце сентября 1951 года врачи не сдались и не перестали давать Генриетте лекарства, не считая обезболивающих. Вскоре лабораторные HeLa осиротели.
Первого рабочего задания бессмертной культуре долго ждать не пришлось. В США бушевала пандемия полиомиелита — Джонас Солк уже придумал свою вакцину, но еще не начал клинические испытания. Чтобы убедиться в том, что она работает, нужно было проверить, появились ли в крови привитых антитела к полиовирусу. Но тестов на антитела в то время не существовало, и единственным способом их обнаружить было взять сыворотку крови, вылить ее на клетки и попробовать заразить их вирусом. Если это не удается — в крови есть антитела.
А значит, нужны были клетки, которые в которые можно подселить полиовирус — причем много клеток. Как раз за пару лет до рождения HeLa вирусологи выяснили, что полиовирус может заражать не только нейроны, но и некоторые другие клеточные типы. Но эмбриональные клетки было непросто получать, и Гай предложил попробовать в этой роли неприхотливую и плодовитую HeLa. Идея оказалась удачной: клетки послушно принимали все три разновидности полиовирусов, давали им размножиться и умирали через 12–96 часов, а на смену им приходили новые.
Когда выяснилось, что полиовакцина Солка работает, для HeLa нашлась новая работа — растить в себе вирусы, которые станут сырьем для «убитой» вакцины. Чтобы в клетках Генриетты Лакс не было недостатка и дальше, для них построили отдельную плантацию — лабораторию Университета Таскиги, откуда каждую неделю по стране рассылали тысячи новых флаконов с HeLa.
Джордж Гай и сам охотно раздавал свои работящие клетки: сначала коллегам в соседние лаборатории, потом в другие города и страны. Сажая очередную партию HeLa в самолет (пилотам иногда приходилось возить пробирки прямо в нагрудном кармане, чтобы не лишать их тепла человеческого тела), Гай шутил, что его клетки готовятся в очередной раз «метастазировать». В течение следующей пары десятков лет у него было множество шансов оценить, насколько пророческой оказалась его шутка.
HeLa оказались пригодны не только для размножения полиовирусов. Они стали новым модельным объектом и золотым стандартом — воплощением среднестатистической человеческой клетки. Биологи начали растить в них и другие вирусы: свинки и кори, герпеса и ветрянки. HeLa замораживали, размораживали, хранили в холодильниках и отправляли по почте, их превращали в гибриды, заставляя сливаться с клетками мыши, и их же первыми из человеческих клеток клонировали — то есть придумали, как вырастить из одной-единственной клетки HeLa целую толпу генетически одинаковых потомков. HeLa даже слетали в космос на советском «Спутнике 6» — и оказалось, что в невесомости они размножаются не хуже, чем на Земле.
В то же самое время, пока одни ученые разводили HeLa и помогали им «метастазировать» снова и снова, другие — в поисках лекарства от рака — пытались их убить. Клетки HeLa облучали рентгеном и обдували кислородом, поливали бактериальными токсинами, антибиотиками и кроличьими антителами. Иногда эксперименты удавались, и теми же веществами, которые сработали против HeLa, пациентов лечат и сегодня.
В это же время кое-кто пытался превратить сами клетки Генриетты Лакс в лекарство. В середине 1950-х их подселили в организмы нескольких десятков тюремных заключенных из Огайо — вирусологи рассчитывали, что встреча с чужой опухолью сработает как прививка от собственных. А некоторым пациентам клетки HeLa кололи просто в качестве теста: считалось, что, если иммунная система с ними не справляется, значит она ослаблена, и где-то в теле прячется недиагностированный рак. Организмы многих подопытных людей сопротивлялись вторжению HeLa, но у кого-то опухоли все-таки вырастали, и иногда метастазировали уже по-настоящему. Так что скольких людей убили эти клетки, не считая Генриетты, — неизвестно.
Потом появились и другие клеточные культуры самых разных тканей, от человеческой кожи до роговицы — десятки разных вариантов, и раковых, и здоровых. Растить их стало проще: то ли потому, что ученые набили руку, то ли потому, что даже обычные клетки в лабораториях иногда приобретали бессмертие — превращались в опухолевые и начинали охотно размножаться.
В середине 1960-х генетик Стэнли Гартлер заподозрил, что некоторые из этих клеток на самом деле не то, за что себя выдают. Чтобы разобраться в этом, он начал искать в них биохимические метки: поскольку разные линии получены от разных людей, у них должны быть разные варианты одних и тех же белков. Первые 20 проанализированных им культур несли в себе белок глюкозо-6-фосфатдегидрогеназу в А-форме — вариант, который встречается относительно редко и почти только у афроамериканцев. Генетик счел маловероятным, чтобы все доноры клеток были одного происхождения, а когда 18 из этих культур совпали по разновидности еще одного белка, заключил, что все они — HeLa.
С тех пор клетки Генриетты Лакс то и дело находят в самых разных культурах. HeLa выдавали себя за клетки кишечника, печени и эмбрионального легкого. Они проникли в культуры почки и прямой кишки. Даже несколько уникальных образцов опухолей, которые в 1973 году СССР передал США в рамках совместных планов по поиску лекарства от рака, — и тех по пути из одних лабораторий в другие вытеснили клетки HeLa.
Попытки разобраться в том, кто есть кто на самом деле, не прекращаются и сейчас. В 2017 году выяснилось, что результаты без малого 33 тысяч научных работ получены на неверно идентифицированных клетках, а еще полмиллиона других статей эти результаты цитируют. Журналы регулярно отзывают опубликованные статьи, когда обнаруживается, что эксперименты, описанные в них, проведены на очередных «метастазах» HeLa под видом какой-то другой культуры. Сейчас в черном списке международного комитета по аутентификации клеточных линий всего 576 клеточных культур, которые не соответствуют своему названию. Из них 140 — HeLa в разных обличьях.
Что ты такое
За долгие годы работы с HeLa биологи узнали о них практически все: что они едят и как часто, когда и как размножаются, как дают отпор иммунитету, какими генами пользуются и какие строят белки. И чем дальше ученые всматривались в недра этих клеток, тем понятнее становилось, что HeLa совсем не похожи на обычные клетки человека.
Отличаются они уже хотя бы тем, что они раковые. В их восьмой хромосоме сидит вирус папилломы человека 18 типа, и своим присутствием заставляет работать ген c-Myc — а это известный онкоген, который регулирует работу других генов и побуждает клетки делиться. Видимо, именно благодаря ему HeLa исправно размножаются раз в сутки на протяжении вот уже семидесяти лет.
У обычных человеческих клеток при таком скоростном делении возникают проблемы. Даже в организме им не приходится так активно размножаться, поэтому они не делают этого и в лаборатории. Те же, кто соглашается делиться в пробирке, быстро от этого устают, потому что лишаются теломер — набоек на концах хромосом, которые с каждым делением становятся немного короче. Но у HeLa, как оказалось, работает специальный фермент теломераза, который наращивает теломеры и дает клетке возможность делиться бесконечно. Впервые у человеческих клеток его заметили именно в HeLa.
Кроме того, у HeLa совершенно неприличное число хромосом. Их 76–80 вместо положенных человеческим клеткам 46. И 22–25 из них аномальные, то есть не просто лишние копии каких-то уже существующих хромосом, а их обломки или вообще химеры из нескольких участков генома.
Судя по всему, хромосомные беспорядки внутри HeLa произошли где-то на заре их жизни: или когда вирус папилломы человека только поселился в клетках Генриетты Лакс, или когда HeLa осваивались во вращающемся инкубаторе доктора Гая. Но за десятки лет в лабораториях число хромосом почти не изменилось. Эта удивительная стабильность говорит о том, что такая геномная аномалия оказалась очень удачной. Другие попытки HeLa перестроить свой геном успехом не увенчались — по крайней мере, поздние образцы опухоли, которые врачи забрали у Генриетты Лакс, в лаборатории не прижились.
Наконец, даже для раковых клеток HeLa оказались нетипичными. Лечащий врач Генриетты Лакс, Говард Джонс, позже писал, что эта опухоль с самого начала показалась ему подозрительной. Размером с 25-центовую монету, ярко-пурпурного цвета, она напомнила ему виноградину из желе, а на ощупь была такой мягкой, что совершенно не отличалась от основной ткани слизистой. Не поверив в то, что это настоящий рак, Джонс поначалу предположил, что это шанкр — поскольку Генриетта с детства была носительницей сифилиса. И только после того, как на мазке не оказалось его возбудителей-спирохет, врач признал, что это опухоль. Правда, неверно определил ее тип: только через 20 лет после рождения HeLa, пересматривая свои записи, Джонс заметил, что это не мутировавший эпителий шейки матки, как он считал все это время, а аденокарцинома — она образуется из ткани маточных желез и встречается реже, зато более агрессивна.
Так что своим рождением HeLa обязаны редкому совпадению. В организме Генриетты Лакс встретились два патогена: вирус папилломы человека и возбудители сифилиса, один из которых превратил обычные клетки в раковые, причем редкого типа, а второй, судя по всему, отвел от них подозрения иммунной системы и позволил опухоли разрастись. Ее клетки начали делиться, беспорядочно перекраивая свои хромосомы, — и в какой-то момент, когда комбинация стала особенно удачной, клетки попали под нож хирурга и переехали в лабораторию Джорджа Гая, откуда и начали расселяться по планете.
Клетки ищут свободу
Сейчас мы уже знаем, что «лабораторная мышь» клеточных биологов на самом деле оказалась редким монстром. То, что долгие десятки лет играло в лабораториях роль типичной человеческой клетки, оказалось ни на одну из них совершенно не похоже. Более того, сегодня есть подозрение, что отдельные линии HeLa с разных концов света уже довольно сильно разошлись и даже друг с другом стали иметь уже не так много общего.
Но самое главное — мы совершенно не понимаем, много ли отношения этот монстр имеет к самой Генриетте Лакс. В ее собственных клетках, было, конечно, не 80 хромосом, а 46, иначе бы она не смогла дожить до 30 лет и стать матерью пятерых детей. Но в какой момент 46 превратились в 80 — внутри ее тканей или уже снаружи — сейчас сказать уже невозможно. От самой Генриетты не осталось никаких других биологических образцов, и мы не можем прочесть ее настоящий геном — а значит не можем узнать, насколько далеко клетки HeLa ушли от своей хозяйки и стоит ли до сих пор считать эту культуру частью ее тела.
В 1991 году двое ученых из Чикаго предложили даровать клеткам HeLa независимость — и выделить их в новый вид, Helacyton gartlerii (в честь Стэнли Гартлера, который первым заговорил об эпидемии HeLa в лабораториях). Они апеллировали к стандартным критериям биологического вида. Например, генетическому: набор хромосом у HeLa не только отличается от того, что несли в себе клетки Генриетты, но и вообще выходит за рамки возможного у людей. Или репродуктивному: HeLa не способны скрещиваться с человеком. Хотя в лаборатории их можно заставить слиться с какой-нибудь другой клеткой, ни о каком обмене генами речи не идет. Наконец, экологический: HeLa занимают в природе собственную нишу, в которой никак не конкурируют с Homo sapiens. Правда, Homo sapiens эту нишу создал — но не сделал ли он того же для множества одомашненных животных?
Но идея не вызвала энтузиазма, и других, более пристрастных, проверок на видовую обособленность HeLa не прошли. Например, ученые заметили, что этим клеткам не хватает четкой родословной — неясно, как выглядит их типичный представитель и каковы были переходные стадии между ним и Генриеттой. К тому же, HeLa продолжают конкурировать с клетками человека — не только в лаборатории, но и в организме незадачливых пациентов — а значит, не так уж и уникальна их экологическая ниша. Так научное сообщество отказало HeLa в независимости. Хотя есть надежда на реванш: недавно было много разговоров о «заразных» (трансмиссивных) опухолях — их, в частности, предложили считать промежуточной стадией на пути к новым видам. Поэтому ученые еще могут передумать.
А пока HeLa остаются — и биологически, и юридически — клетками человека. И это всерьез осложняет жизнь не только им самим, но и тем, кто их разводит и содержит.
С одной стороны, биологический материал, который пациент оставляет в кабинете врача, не считается больше его собственностью — по крайней мере, такое решение неоднократно выносили судьи. С другой стороны, у HeLa есть немало общего с другими наследниками Генриетты Лакс — например, часть генома. Поэтому в 2013 году, когда геном HeLa отсеквенировали, его пришлось убрать из открытого доступа — внуки Генриетты сочли это вторжением в свою частную жизнь. А сейчас они подали иск к компании Thermo Fisher Scientific, требуя компенсации за то, что компания торговала клетками Генриетты Лакс без ее согласия. Это не единственный продавец, у которого сегодня можно купить HeLa, так что за этим иском наверняка последуют другие.
70 лет назад врачи отделили клетки опухоли от организма Генриетты Лакс, но связь между ними не разорвалась — оказывается, и к содержимому чашки Петри можно отнестись по-человечески. В этом HeLa не одиноки: похожая история складывается с культурой HEK293 — ее безвестный хозяин был зародышем и стал донором, не дожив до появления на свет. HEK293 тоже десятилетиями работала на ученых — и как модельный объект, и как производитель белков — а в 2020-м году ее подрядили на производство коронавирусных вакцин. В США католическая церковь тут же призвала отказаться от этих вакцин и пользоваться более этичными препаратами. Хотя найти вакцину, над которой не поработали эти клетки, не так-то просто: в ней выращивают большинство векторных вакцин (от компаний AstraZeneca и Cansino, а также российский «Спутник V», и только Johnson&Johnson используют другую линию, правда, тоже эмбриональную), а мРНК-вакцины (которые создали Pfizer и Moderna) на ней тестируют.
А пока врачи, гистологи и родственники Генриетты Лакс воюют за право собственности над HeLa, клетки продолжают трудиться. В создании современных вакцин они уже не участвуют, отработав свое на полиомиелитных плантациях. Но продолжают служить модельной клеткой человека и в ковидную эпоху: например, про то, что коронавирус попадает в клетки с помощью рецептора ACE2, ученые узнали, пытаясь заразить новым вирусом культуру HeLa.
Прожив на свете в два с лишним раза дольше самой Генриетты, покорив все континенты и побывав в космосе, принеся ученым десяток Нобелевских премий и защитив от полиомиелита миллионы детей, клетки HeLa так и не заработали себе независимость. Но они не собираются сдаваться: эволюция не стоит на месте — меняются нравы и меняются геномы. И прямо сейчас в тысячах инкубаторов на Земле вечные осколки Генриетты Лакс настойчиво копируют свою ДНК, готовясь мутировать, эволюционировать и дальше бороться за свою свободу.
Автор: Полина Лосева