Биологи из Вашингтонского университета штата Сиэттл смогли восстановить нейроны сетчатки у мышей.
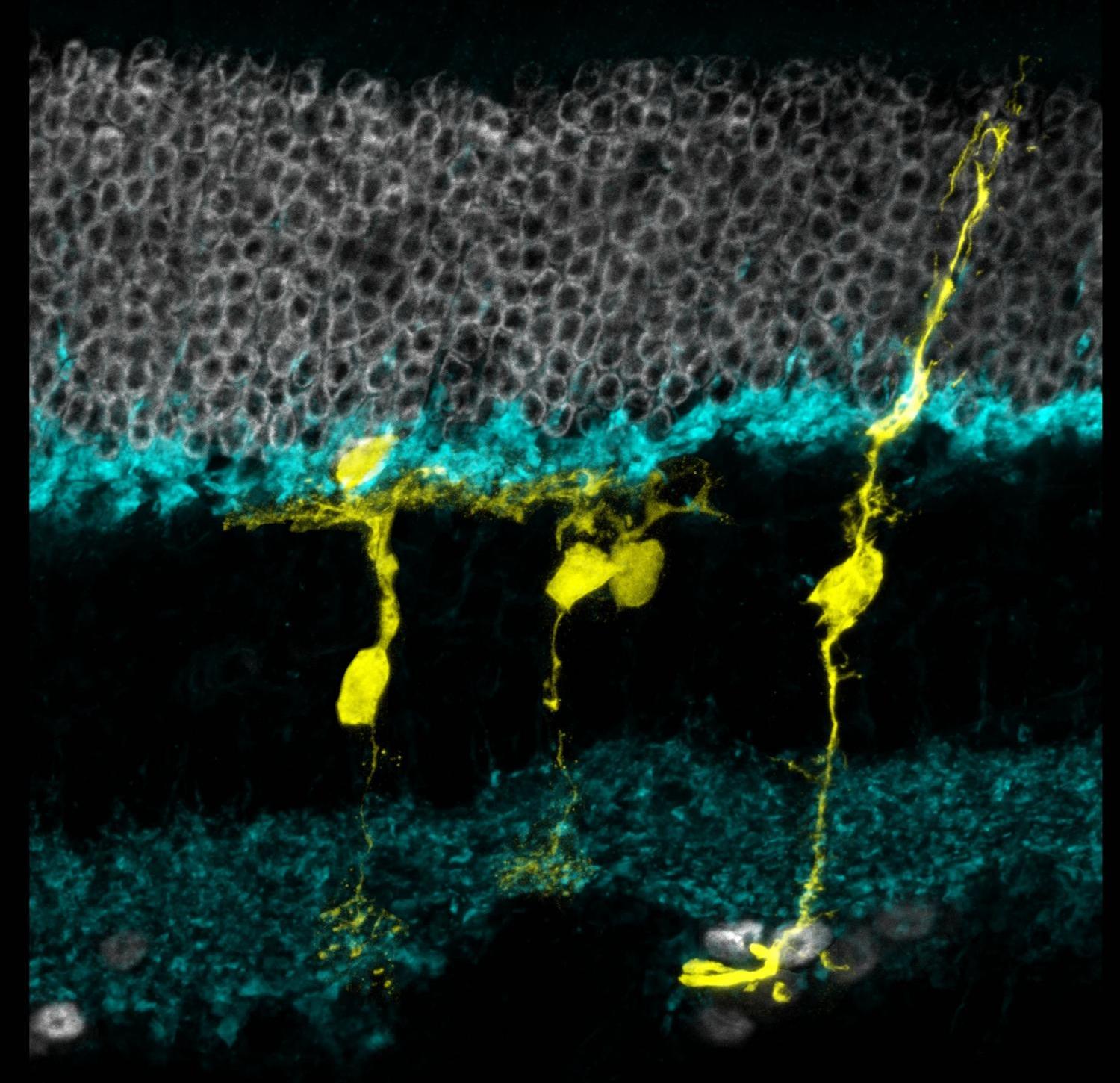
Этого удалось добиться с помощью включения регулятора транскрипции Ascl1 клеток Мюллера, который участвует в восстановлении сетчатки у рыб, а также добавления ингибитора гистоновых деацетилаз, что обеспечило доступ к нужным генам даже в хромосомах взрослых мышей. Исследование опубликовано в Nature Letter, а интервью с учеными и краткий обзор работы выложены на Eurekalert.
Сетчатка — внутренняя оболочка глаза, которая является воспринимающей частью и первичным анализатором зрительного органа. Она состоит из десятка разных слоев клеток, которые воспринимают потоки света, обрабатывают сигналы и передают их по зрительным нервам в головной мозг. Мюллеровские глиальные клетки, простирающиеся от внутренней до внешней пограничной мембране сетчатки, у амфибий, рыб и некоторых других животных способны выполнять роль своеобразных стволовых клеток и участвуют в регенерации сетчатки, образуя новые нейроны взамен разрушенных. У млекопитающих регенерация сетчатки не осуществляется. Мюллеровские клетки участвуют в проведении световых сигналов, но не способны чинить дефекты. Необратимость нарушений сетчатки, например, вследствие развития глаукомы, является серьезной проблемой современной медицины.
У рыб-данио, которые в данном исследовании служили примерным объектом, мюллеровские клетки превращаются в нейроны при разрушении сетчатки за счет включения гена регулятора транскрипции Ascl1 и последующего запуска ряда процессов. У млекопитающих этот ген тоже есть, но экспрессия его в соответствующий момент не активируется. Ученые научились включать экспрессию фактора Ascl1 искусственным путем у мышей, создав регулируемый промотор к его гену. Мышам предварительно вводили вещества, разрушающие нейроны сетчатки, и смотрели, станут ли мюллеровские клетки заменять их.
После включения промотора экспрессия Ascl1 успешно начиналась, однако этот эффект, как уже было показано в предыдущих работах, наблюдался только у новорожденных мышей. Как выяснилось, у взрослых мышей доступ к необходимым для превращения мюллеровских клеток генам был закрыт вследствие эпигенетических факторов (изменения конфигурации хромосом за счет взаимодействия с белками-гистонами). Добавление трихостатина-А, ингибитора гистоновых деацетилаз, повысило уровень ацетилирования гистона H3 K27 и предотвратило эти изменения, «открыв» нужный участок на хромосоме. После этого экспрессия Ascl1 успешно включалась и у взрослых мышей.
Мюллеровские клети уже через полторы-две недели эффективно превращались в нейроны, обладающими соответствующими маркерами (например, Otx2), и теряли глиальные маркеры (например, Sox9). Ученые отмечают, что новообразованные нейроны сами начинали создавать правильные «контакты» с остальными частями сетчатки, реагируя на свет, воспринимая сигналы и передавая информацию дальше, поэтому отдельно придумывать, как решать эту проблему, оказалось не нужно.
В будущем ученые собираются научиться проводить подобные манипуляции для получения любых необходимых нейронов. Раньше мы уже рассказывали, как в другом исследовании с помощью вирусных векторов астроциты заставляли превращаться в дофаминовые нейроны. Подобные манипуляции с перепрограммированием клеток, по-видимому, скоро станут важным методом при лечении ряда заболеваний и нарушений нервной системы.
В другой работе стволовые клетки пробовали пересаживать мышам непосредственно, добиваясь хороших результатов даже на терминальной стадии дегенерации сетчатки.
Автор: Анна Казнадзей