Немецкие исследователи обнаружили новую защитную роль аутофагии в нервных клетках. Как выяснилось, она оказывает больший протективный эффект не за счет утилизации ненужных белков, а за счет того, что не дает одному из клеточных органоидов – эндоплазматической сети – накапливать критические уровни кальция, который приводит к смертельной гипервозбудимости клетки.
Процесс аутофагии необходим каждой клетке для того, чтобы отыгравшие свою роль или дефектные белки не замусоривали внутриклеточное пространство, а шли на «переработку» и утилизацию. Причем, клетки могут подобным образом решать вопросы даже с целыми органеллами – например, митохондриями. За открытие этого механизма, чрезвычайно важного для долгоживущих нейронов, в 2016 году вручили Нобелевскую премию по физиологии или медицине японскому исследователю Ёсинори Осуми.
Защитные свойства аутофагии именно для нервных клеток и ее важность для межсинаптической передачи доказывались в огромном количестве исследований (вот здесь можно прочесть прекрасный свежий обзор). Тем не менее не до конца изучено, за счет чего конкретно эти свойства обеспечиваются. По самой распространенной версии, аутофагия позволяет избавляться от белковых и прочих «шлаков», тем самым поддерживая долгую жизнь нейрона. Однако ученым из Научно-исследовательского института молекулярной фармакологии (FMP) и Клиники Шарите удалось увидеть и иное, возможно, даже более важное для выживаемости клеток значение этого процесса.
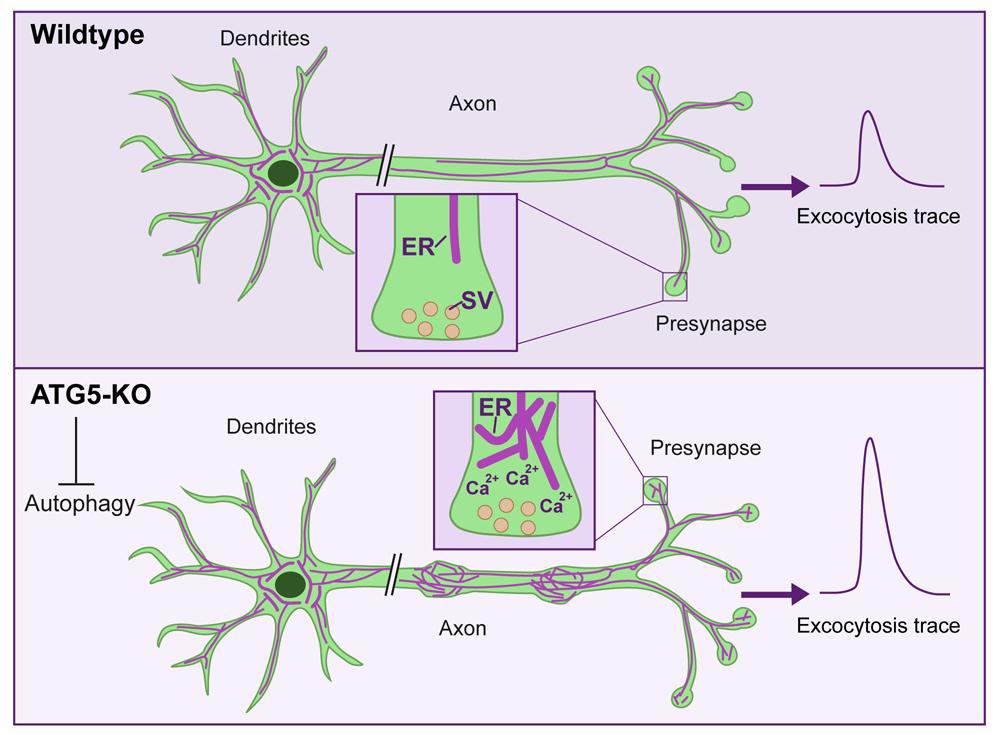
Для этого они создали генно-модифицированную линию мышей, в нервных клетках которых «отключили» ген отвечающего за аутофагию белка ATG5. С помощью количественно протеомического анализа они затем пронаблюдали, насколько изменится состояние клеток, ожидая, что их начнет переполнять внутриклеточный «мусор». Однако, на удивление, они ничего подобного не увидели, но зарегистрировали нечто иное.
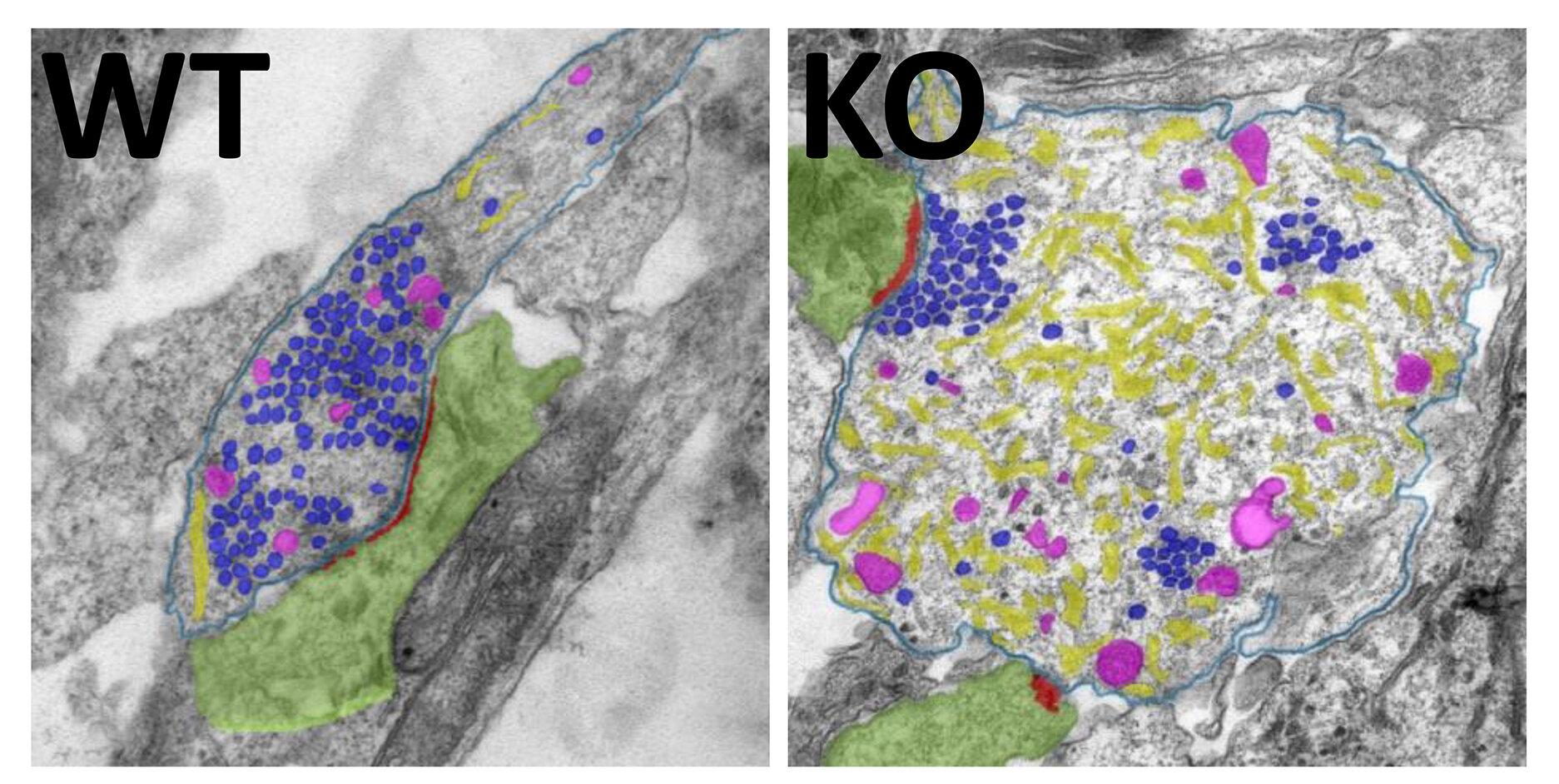
В ответ на сниженную аутофагию в аксонах (длинный отростках) нейронов значительно повысилось содержание клеточных органелл – эндоплазматической сети (или ретикулума, ЭПР), представляющей собой переплетения канальцев и мешочков. Одна из его функций – это накопление кальция, необходимого для того, чтобы запустить выход нейромедиатора в синаптическую сеть. То есть – для передачи сигнала. В момент клеточного возбуждения в синапсе открываются кальциевые каналы, через которые внутрь клетки поступает внеклеточный кальций. Он инициирует освобождение везикул (пузырьков) с нейромедиатором, а затем либо может быть откачан из клетки, либо отложен в эндоплазматические депо «на черный день».
Отключение аутофагии привело к нарушению слаженной работы всей системы – кальций перестал выводиться и начал чрезмерно накапливаться в ЭПР. Это привело к патологически частому выделению нейромедиатора глутамата и «перегреву» нейронов. Подобное явление носит название эксайтотоксичности и выступает в роли «серого кардинала» многих неврологических патологий, включая боковой амиотрофический склероз.
«До сих пор предполагалось, что снижение аутофагии приводит к снижению количества молекул-передатчиков. Но теперь мы продемонстрировали прямо противоположное. Проблема в том, что нейромедиаторов не лишком мало, а слишком много. В результате нейроны становятся менее пластичными, и мы подозреваем, что они в конечном итоге погибают от гипервозбудимости», — отмечают авторы работы.
Поскольку исследование проводилось на здоровых нейронах молодых животных, исследователи не исключают, что картина нарушения аутофагии, которая будет наблюдаться в патологических условиях, например, при болезни Альцгеймера и других недугах, окажется гораздо более яркой и неожиданной. Возможно, даже именно поэтому с возрастом ухудшается и нейропластичность. Гиперактивированные синапсы уже достигли своего предела и более не могут усиливаться пластически – а ведь это основное требование для обучения и усвоения новой информации.
Кажется, немецкие ученые приподняли новый пласт патологической нейрофизиологии, который теперь предстоит внимательно раскрывать слой за слоем. Подробности работы опубликованы в журнале Neuron.
Текст: Анна Хоружая