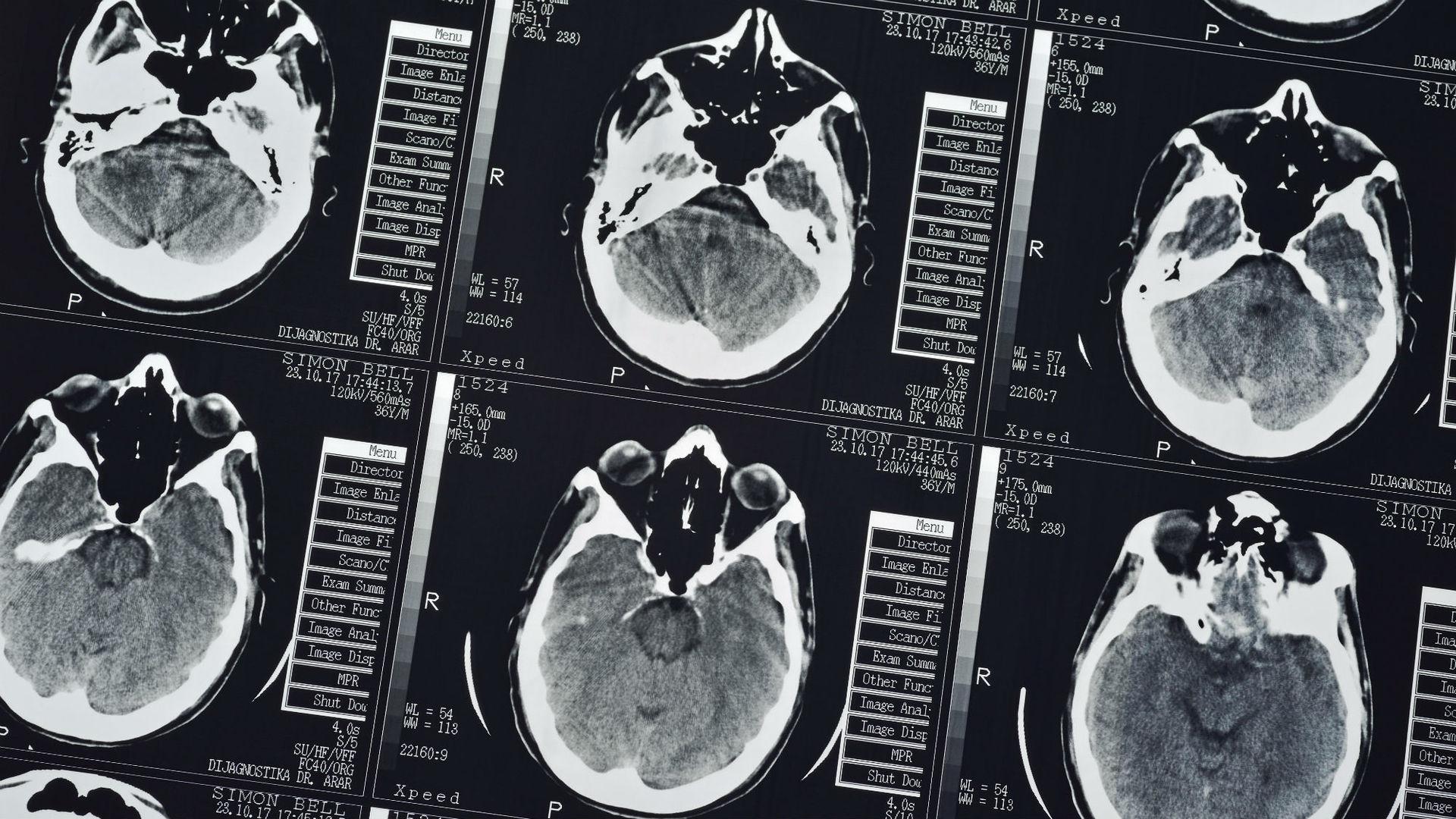
Специалисты Университета Кейс Вестерн резерв впервые в истории синтезировали искусственный человеческий прион, что в конечном итоге может помочь в разработке лечения болезни Крейтцфельдта-Якоба и других смертельных расстройств, нарушающих работу мозга.
Так называемые прионные болезни (например, коровье бешенство) характеризуются изменением тканей головного мозга (образуются полости, и мозг приобретает губчатую структуру). Болезнь ведёт к деградации умственных и физических способностей и в итоге убивает человека или животное.
Причина — прионы, особый класс инфекционных агентов, имеющих белковую природу. Они размножаются за счёт работы клеток, в которых располагаются. В этом отношении они очень похожи на вирусы, которым для существования и выживания также приходится заражать клетки хозяина.
На сегодня известно, что прионы – это аномально свёрнутые инфекционные агенты, которые вызывают изменения в структуре нормальных белков. Специалисты впервые открыли прионы в 1980-х годах. Тогда же им приписали роль виновников фатальных нарушений работы мозга, которые назвали общим термином трансмиссивные губчатые энцефалопатии, или прионные болезни.
Прионы могли бы показаться безобидной «ошибкой» природы, если бы они не вызывали целый каскад разрушительных процессов, во время которых прионы «захватывают» здоровые белки поблизости и вызывают образование микроскопических полостей в тканях мозга. Всё это приводит к устойчивому и необратимому ухудшению состояния больного.
Самым распространённым прионным расстройством является болезнь Крейтцфельдта-Якоба. Зачастую недуг приводит к слабоумию, потере памяти, нарушению двигательных навыков, потере зрения и, в конечном итоге, смерти человека. Летальный исход наступает в 85% случаев при лёгкой форме, а в случае тяжёлой излечение и вовсе невозможно.
Учёные считают, что 90 процентов прионных заболеваний человека возникает самопроизвольно, и лишь 9-10 процентов – это результат генетики. Менее одного процента – следствие поедания останков заражённых животных. (Тревогу вызывает тот факт, что прионы в мясе не разрушаются в ходе обычных методов приготовления.)
Случаи передачи прионов через кровососущих насекомых достаточно редки, но длительные инкубационные периоды таких болезней (заболевание может скрываться в головном мозге в течение 30 лет, прежде чем нанесёт серьёзный ущерб) и высокая устойчивость к лечению вызывают серьёзную озабоченность специалистов.
Авторы нового исследования в своей статье в журнале Nature делают вывод, что на сегодняшний день контролировать распространение таких болезней и лечить их очень тяжело.
Например, молекулярные процессы, определяющие ход этих опасных заболеваний мозга, плохо изучены. По этой причине все исследования прионов невероятно важны, и недавняя работа демонстрирует долгожданный прогресс.
Как уже отмечалось выше, команда исследователей под руководством Джири Сафара (Jiri G. Safar) впервые создала в лаборатории искусственный штамм человеческих прионов.
Поясним, что ранее учёные уже создавали синтетические прионы, но они были характерны лишь для грызунов. Благодаря последним исследователи смогли получить некоторые данные и изучить ранее неизвестные детали прионных заболеваний, но только у мышей и хомяков. Тем не менее «смертельные белки» действуют в организме людей немного по-другому: они отличаются как по структуре, так и по механизму репликации.
В новой же работе команда Сафара использовала человеческий белок приона и при помощи некоторых ухищрений сумела заставить кишечную палочку создать «высоко разрушительный синтетический человеческий прион».
В рамках исследования учёные выяснили, что соединение под названием ганглиозид GM1 (ganglioside GM1, молекула, регулирующая связь между клетками) отвечает за запуск репликации и передачу прионной болезни.
По словам авторов работы, это открытие невероятно важно, поскольку теперь специалисты могут начать создавать лекарства, блокирующее эту молекулу.
Кроме того, исследователи выяснили, что простое наличие неверно сложенных белков не вызывает тяжёлое прионное заболевание. Важны определённые изменения в аминокислотных цепях в структуре приона, которые определяют, как быстро он реплицируется, насколько он «заразен» и на какие структуры мозга нацеливается.
Результаты работы также показали, что полученные синтетические человеческие прионы являются инфекционными для трансгенных мышей, которые были генетически изменены таким образом, чтобы их организмы создавали некоторые человеческие белки.
В двух отдельных экспериментах рекомбинатный человеческий прион привёл к серьёзной неврологической дисфункции у заражённых мышей в среднем спустя 224-459 дней.
Впрочем, исследователи пока не могут точно сказать, как именно этот искусственный прион будет влиять на мозг человека.
Конечно, медики всё ещё далеки от лечения прионных болезней, но теперь у учёных, по крайней мере, есть план по созданию синтетических человеческих прионов в лаборатории.
По мнению Сафара, исследование является переломным моментом. «Ранее наше понимание природы прионов было ограничено. Возможность создавать синтетические человеческие прионы в пробирке позволит нам достичь гораздо более глубокого понимания структуры и репликации прионов», — говорит учёный.
Данное исследование позволит разработать ингибиторы (замедлители) их репликации и распространения по мозгу. Новое открытие также поспособствует пониманию того, как болезни, причиной которых являются прионы, развиваются в человеческом мозге.
К слову, ранее мы писали о том, что белок, действующий подобно этому инфекционному агенту, впервые обнаружен в бактериях. Ранее прионы находили только в клетках эукариотических организмов – растений и животных.
Автор: Евгения Ефимова