В новом исследовании, опубликованном в очень авторитетном журнале Neuron, ученые установили, что визуальная и слуховая стимуляция вызывают специфические гамма-ритмы в коре головного мозга, что, в свою очередь, предотвращает появление амилоидных бляшек у мышей, генетически предрасположенных к развитию болезни Альцгеймера.
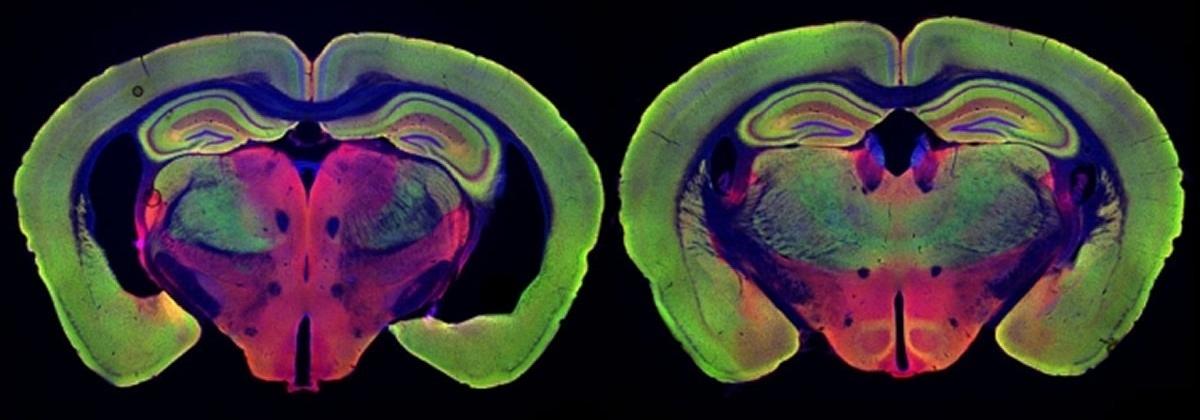
Ежедневное проведение процедур на ранних стадиях нейродегенерации помогает сохранить нейронную и синаптическую плотность в разных областях мозга и улучшает когнитивные способности и пространственную память.
Несколько лет назад неврологи из Массачусетского технологического института показали, как они могут значительно уменьшить амилоидные бляшки, наблюдаемые у мышей с болезнью Альцгеймера, просто подвергая животных воздействию мерцающего света с определенной частотой.
Ли-Хуэй Цай и ее коллеги обнаружили, что зрительная стимуляция с частотой 40 герц (циклов в секунду) вызывает мозговые волны, известные как гамма-колебания в зрительной коре. Считается, что эти мозговые волны способствуют нормальным функциям мозга, таким как внимание и память. Также предыдущие исследования показали, что у пациентов с болезнью Альцгеймера этот процесс нарушен.
Позже исследователи обнаружили, что сочетание мерцающего света со звуковыми стимулами (тоны частотой в 40 герц) еще больше уменьшало бляшки, а также имело более отдаленные эффекты и распространялось на гиппокамп и части префронтальной коры.
В своем новом исследовании ученые хотели глубже вникнуть в то, как возникают эти эффекты. Они сосредоточились на двух модифицированных линиях мышей, которые генетически запрограммированы на развитие симптомов болезни Альцгеймера. Один из них, известный как TauP301S, имеет мутированную версию белка Tau, которая образует нейрофибриллярные сплетения, подобные тем, которые наблюдаются у пациентов с болезнью Альцгеймера. Другой, известный как CK-p25, может вызывать выработку белка p25, который способствует развитию тяжелой нейродегенерации. По словам Цай, обе эти модели вызывают большую потерю нейронов, чем модель, которую они использовали для первоначального исследования действия мерцающего света.
Исследователи обнаружили, что визуальная стимуляция, проводимая один час в день в течение трех-шести недель, оказала значительное влияние на дегенерацию нейронов. Они начали лечение незадолго до того, как можно было ожидать начала дегенерации. После трех недель лечения у мышей TauP301S, которые составили опытную группу, не было выявлено дегенерации нейронов, тогда как мыши из контрольной группы TauP301S, которые не участвовали в эксперименте, потеряли от 15 до 20 процентов своих нейронов. Нейродегенерацию также предотвращали у мышей из опытной группы CK-p25, которых лечили в течение шести недель.
«Я работаю с белком р25 более 20 лет, и я знаю, что это очень нейротоксичный белок. Мы обнаружили, что уровни экспрессии трансгена p25 у мышей из опытной и контрольной группы абсолютно одинаковы, но у мышей из опытной группы, которые получали лечение, нейродегенерации нет, — говорит Ли-Хуэй Цай, директор Института обучения и памяти Пикауэра и старший автор исследования. — Я не видела ранее ничего подобного. Это шокирует».
Экспериментальная группа мышей показывала гораздо лучшие результаты в тестах пространственной памяти (водный лабиринт Морриса), чем мыши из контрольной группы. Интересно, что «терапия» также улучшила пространственную память у пожилых мышей, не имевших предрасположенности к болезни Альцгеймера.
Чтобы попытаться выяснить, что происходило на клеточном уровне, исследователи проанализировали изменения в экспрессии генов в опытной и контрольной группах мышей. Изучались изменения как в нейронах, так и в микроглии — иммунных клетках, которые отвечают за удаление «мусора» из мозга (подробнее об этих интереснейших клетках читайте в нашей специальной статье).
В целом, индукция гамма-колебаний способствует уменьшению воспаления, улучшению синаптической функции и защите нейронов от гибели.
В нейронах мышей из контрольной группы исследователи увидели снижение экспрессии генов, ответственных за репарацию ДНК, а также отметили ухудшение переноса мембранных везикул, что важно для нормального функционирования синапсов. Мыши, получавшие лечение, показали гораздо более высокую экспрессию этих генов.
Исследователи также обнаружили большее количество синапсов у мышей из опытной группы, а также более высокую степень когерентности (показатель синхронизации мозговых волн между различными частями мозга).
В своем анализе микроглии исследователи обнаружили, что клетки у мышей, которые не получали лечение, увеличивали экспрессию генов, способствующих воспалению. А у мышей из опытной группы наблюдалось поразительное снижение этих генов наряду с повышением экспрессии генов, связанных с подвижностью. Это наводит на мысль о том, что у мышей, получавших лечение, микроглия может лучше справляться с воспалением и уничтожать молекулы, которые могут привести к образованию амилоидных бляшек и нейрофибриллярных сплетений.
Цай говорит, что ключевой вопрос остается без ответа: как гамма-колебания вызывают все эти защитные реакции?
«Многие люди спрашивают меня, является ли микроглия ключевым типом клеток, предотвращающих развитие болезни Альцгеймера, но, честно говоря, мы не знаем, — говорит Цай, — В конце концов, колебания инициируются нейронами, и мне кажется, что именно нейроны являются главными регуляторами».
Исследователи также планируют протестировать лечение на мышах с более выраженными симптомами, чтобы увидеть, можно ли обратить вспять дегенерацию нейронов после ее начала. Они также начали первую фазу клинических испытаний световой и звуковой стимуляции.
Текст: Анастасия Тихомирова