Что в природе вносит разнообразие, то есть, полиморфизм в аминокислотную последовательность белков в разных организмах, от бактерий до человека?
Во-первых, это изменчивость последовательности генома этих существ, когда варианты в кодирующей белки части ДНК приводят к аминокислотным заменам. Во-вторых, у эукариот это широко известное явление альтернативного сплайсинга, когда при процессинге матричной РНК, считанной с прерывистых генов, в зависимости от обстоятельств меняется набор экзонов, сохраняемых в зрелом транскрипте, с которого и будет считан белок.
Менее изученное явление — это природное редактирование матричных РНК, при котором специальные ферменты химически модифицируют ее остатки, в ходе чего иногда могут также образовываться аминокислотные замены. Например, аденозиндезаминазы семейства ADAR способны преобразовывать остатки аденина в матричной РНК в инозин, вследствие чего перекодируется последовательность белка. Дело в том, что рибосомальный аппарат при трансляции воспринимает инозин не как аденин, а как гуанин. Понятно, что это меняет генетический код и в ряде случаев вносит изменения в аминокислотную последовательность.
Мы с коллегами уже несколько лет занимаемся исследованием полиморфизма аминокислотной последовательности в протеомных данных, полученных при помощи масс-спектрометрии высокого разрешения. Напомню, что протеомика — это высокоэффективный анализ белков, когда в одном образце при помощи масс-спектрометра удается выявить белковые продукты тысяч генов. Сегодня протеомика работает в “постгеномном” режиме, то есть, для идентификации белков в ней используются геномные последовательности. Соответственно, она увидит только те белки, последовательности которых мы “скормили” соответствующему программному обеспечению. Например, если мы исследуем образец злокачественной опухоли и используем для протеома усредненный, так называемый “консенсусный” геном, наш метод окажется слеп к мутантным белкам, вероятно находящимся в этом раковом образце. А ведь именно эти белки часто вызывают бесконтрольное размножение клонов раковых клеток! Искать необычные последовательности в гуще протеомов оказалось непростой задачей.
После того, как мы наладили биоинформатический “конвейер” для идентификации мутантных белков в злокачественных клетках, мне пришла мысль похожим способом поискать в протеомах последствия редактирования РНК аденозиндезаминазами, поскольку именно этот вид редактирования оказался наиболее распространенным. Изучив вопрос в литературе, мы поняли, что в этой работе невольно соприкоснемся с нейронауками. Оказалось, что последствия редактирования РНК на белковом уровне известны в центральной нервной системе. Плодовые мушки-дрозофилы, лишенные этого процесса путем генных манипуляций, становятся, грубо говоря, паралитиками, а менее живучие мыши умирают в страшных судорогах, только успев родиться. Молекулярную основу этого явления у млекопитающих связывают с заменой глутамина на аргинин внутри одного из глутаматных рецепторов, в ходе чего снижается возбудительная активность нейронов, в которых находится этот рецептор.
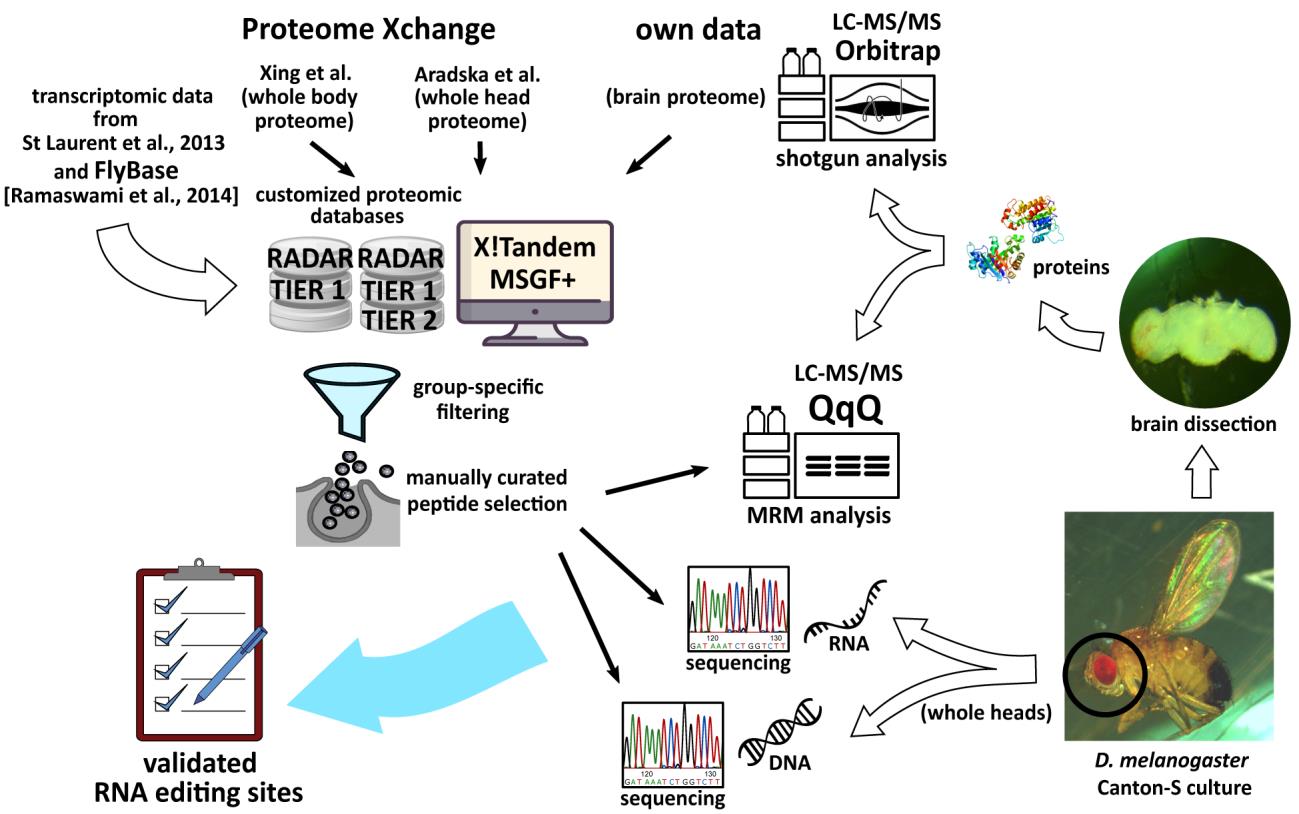
Мы начали свою работу с дрозофилы. Из литературных данных получили сведения о потенциально кодирующих участках редактирования РНК, составили измененную базу данных для протеомного поиска, получили протеомные данные из открытых источников. Оказалось, что до сих пор никто не делал протеомный анализ изолированного головного мозга этого насекомого. Именно этот материал мы проанализировали и, в итоге, впервые обнаружили несколько десятков участков потенциального редактирования на белковом уровне.
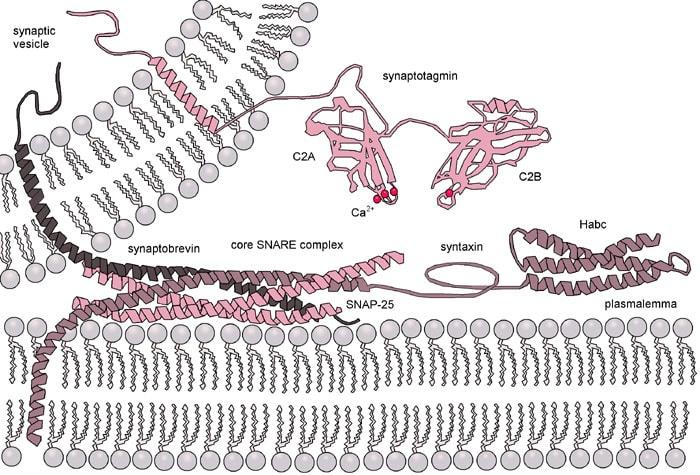
Особенно воспроизводимыми оказались результаты по редактированию аминокислотных последовательностей белков, связанных с пресинаптической мембраной, в частности, консервативного у большинства многоклеточных организмов комплекса SNARE. Белки этого комплекса, чувствительные к повышению внутриклеточного кальция, обеспечивают обратимое слияние синаптических пузырьков с пресинаптической мембраной (рис.2).
Наиболее интересные находки отредактированных белков были дополнительно проверены посредством так называемой направленной масс-спектрометрии. Анализ носил количественный характер, и мы смогли оценить отношение концентраций в мозге мушки закодированных в геноме и отредактированных последовательностей. Например, оказалось, что у взрослых мух отредактирована большая часть белка эндофилина А, который обеспечивает изгиб внутриклеточных мембран, связанных с синаптической функцией. Интересно, что редактирование касается контактирующей с мембраной части белка, где эволюционно консервативный остаток лизина менялся на глутаминовую кислоту, с изменением электростатических свойств остатка на противоположный знак. Гипотетически это изменение должно существенным образом менять сродство соответствующего домена к синаптической мембране.
Таким образом, пилотное исследование позволило сформировать несколько проверяемых гипотез. По-видимому, редактирование РНК у дрозофилы обеспечивает дополнительную настройку синаптической передачи. На каких стадиях развития насекомого и в ответ на какие факторы среды это может происходить, пока остается невыясненным. Отмечу, что это можно исследовать с помощью разработанных нами инструментов.
Работа недавно принята к печати в профильный Journal of Proteome Research. В проекте участвовали исследователи, представляющие Институт биомедицинской химии и Институт энергетических проблем химической физики РАН, сотрудники Второго Меда (сейчас — РНИМУ имени Н.И. Пирогова) и Физтеха, а также коллеги из Каролинского института Швеции. Исследование поддержано грантом Российского научного фонда.
Текст: Сергей Мошковский