Американские ученые обнаружили ключевой участок головного мозга, отвечающий за формирование ассоциаций между факторами окружающей среды и наркотическими веществами у зависимых.
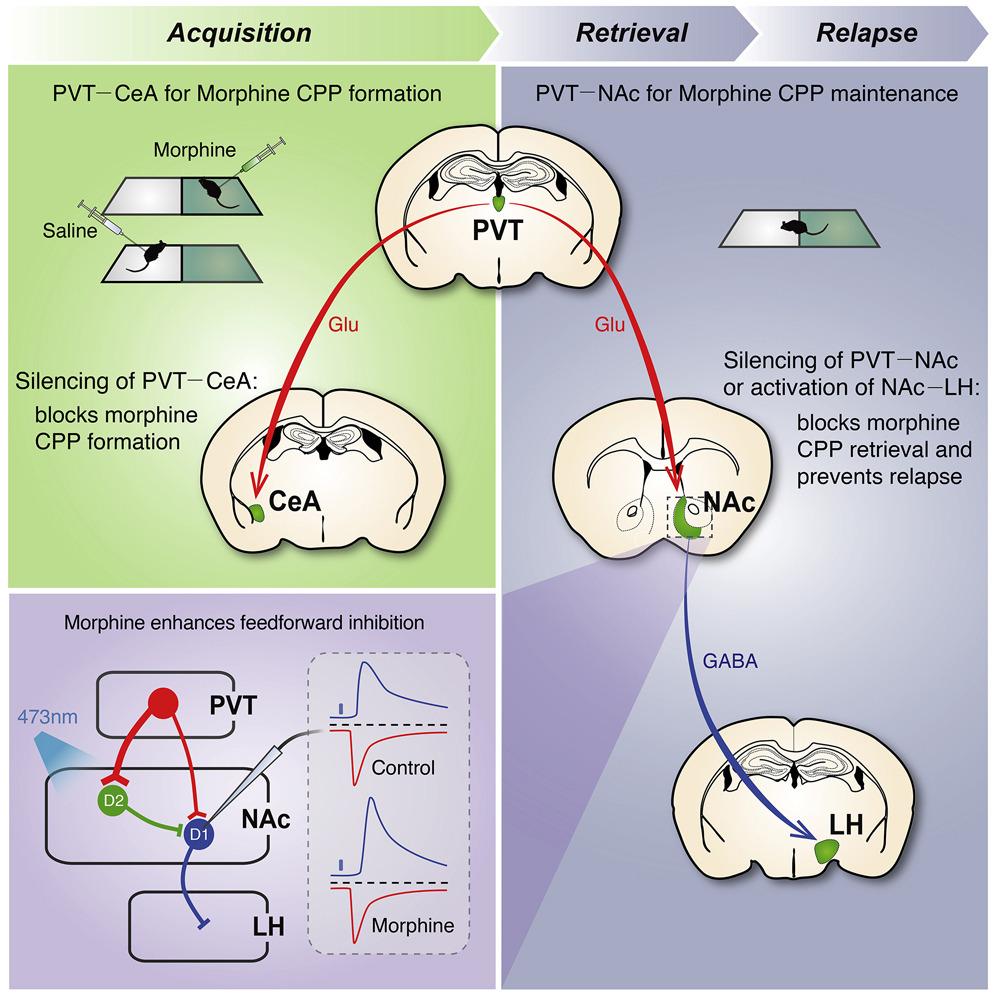
Им оказалось паравентрикулярное ядро таламуса: ингибирование его связей с миндалевидным телом и прилежащим ядром привело к тому, что зависимые от морфина мыши либо не могли привыкнуть к той комнате, в которой им давали наркотик, либо быстро теряли к ней интерес. Обнаруженные связи можно использовать для разработки методов лечения зависимостей — по крайней мере, опиоидных, пишут ученые в журнале Neuron.
В формировании зависимостей одну из ключевых ролей играет связь между объектом аддикции и сопутствующими ощущениями: при наркозависимости, например, потребление вещества связано с получением удовольствия, а отсутствие вещества — с абстинентным синдромом разной степени тяжести. Возникает такая связь очень быстро, хотя и не всегда ведет к зависимости: здесь свою роль играют сторонние факторы, которые могут, например, активировать компенсаторные механизмы, препятствующие тому, чтобы зависимость все же появилась.
Промежуточным звеном здесь могут быть факторы окружающей среды: при уже сформированной связи между объектом аддикции и получаемыми ощущениями такие факторы могут усиливать желание. Так, например, у зависимых от табака связаны стремление покурить и запах сигаретного дыма или вид курящих людей. Влияние на это промежуточное звено — один из самых действенных способов избавления от зависимостей, но он не всегда работает одинаково эффективно: для того, чтобы перестать связывать то, что происходит вокруг, с объектом зависимости и удовольствием, которое приводит к его потреблению, мало только избавиться от внешних факторов.
С другой стороны, помочь может таргетирование воспоминаний, которые как раз связывают внешние факторы и зависимость, в особенности — на уровне головного мозга. Ученые из Стэнфордского университета под руководством Сяокэ Чэнь (Xiaoke Chen) предположили, что ключевую роль в формировании таких воспоминаний может играть паравентрикулярное ядро таламуса (проекции его нейронов связывают его участвующими в зависимости отделами: прилежащим ядром и миндалевидным телом) и именно его необходимо таргетировать для избавления от зависимости.
Чтобы это проверить, ученые провели эксперимент на мышах. Для этого они использовали классическую парадигму условного предпочтения места. Мышей пускали в клетку с двумя комнатами и после того, как они выберут одну, вводили им физраствор и держали там же в течение 45 минут в течение четырех дней каждый день. После этого мышам вводили морфин и повторяли процедуру, но уже с другой комнатой. По окончании периода привыкания мышам позволяли выбирать, в какую комнату пойти: зависимые от морфина мыши всегда выбирают ту комнату, в которую их садили сразу после того, как вещество было введено.
Активность мозга мышей изучали с помощью кальциевой визуализации: для этого в паравентрикулярное ядро таламуса мышам ввели аденоассоциированный вирус, экспрессирующий индикатор, который связывается с ионами кальция при возникновении у нейронов потенциала действия. В другие терминалии других участков — миндалевидное тело и прилежащее ядро — мышам имплантировали оптическое волокно. Таким образом, ученые фотометрически измеряли появление ионов кальция (и, соответственно, активности нейронов) как в паравентрикулярном ядре, так и в нейронных путях от него к другим участкам.
Ученые выяснили, что активность пути между паравентрикулярным ядром таламуса и центральным ядром миндалевидного тела необходима для формирования связи между определенной комнатой и тем, что именно в ней мышь может получить морфин. Мыши, которым ингибировали путь искусственными препаратами, предварительно внедрив DREADD-рецепторы, значительно (p < 0,001) реже проявляли интерес к морфиновой комнате во время тренировки (то есть тогда, когда их пытались «подсадить» на вещество). Интересно, что такой эффект сохранялся и на следующий день, когда активность пути никак не ограничивали.
При этом активация этого пути оптогенетически — с помощью внедрения каналродопсина-2, возбуждаемого лазером с длиной волны в примерно 470 нанометров — не привела к тому, что мыши начали активнее искать проход к морфиновой комнате. Это означает, что связь между паравентрикулярным ядром и миндалевидным телом не связана с поиском вознаграждения как таковым, а как раз помогает связать факторы внешней среды с веществом, формируя ассоциацию.
Что касается пути между паравентрикулярным ядром таламуса и прилежащим ядром, то его DREADD-ингибирование приводило к тому, что мыши переставали связывать определенную комнату с получением морфина: мыши проявляли значительно (p < 0,001) меньше интереса к морфиновой комнате через сутки и десять дней после ингибирования пути. Ученые заключили, что этот путь отвечает за хранение воспоминаний об уже сформированной связи между комнатой и тем, что в ней можно получить морфин, что, по сути, предотвращает рецидив.
Post mortem анализ тканей головного мозга (а точнее — экспрессии фактора c-Fos, указывающего на активность мозга) показал, что ингибирование пути между таламусом и прилежащим ядром снижает активность 22 разных участков по всему головному мозгу. Среди них оказалась латеральная часть гипоталамуса («командного центра» памяти), роль которого в формировании воспоминаний о веществе ученые изучили далее. Для этого ученые отследили активность проекций нейронов из паравентрикулярного ядра таламуса в прилежащее ядро и из прилежащего ядра в гипоталамус у новой группы мышей, зависимых от морфина: оказалось, что у зависимых мышей проекции нейронов из первого ядра ко второму пути (из прилежащего ядра в гипоталамус) переключаются с возбуждения на ингибирование. Дополнительные эксперименты на других мышах показали, что в случае, если путь между прилежащим ядром и гипоталамусом вновь сделать возбуждающим, то рецидива не происходит точно так же, как в случае, когда был ингибирован путь между таламусом и прилежащим ядром.
Авторы пришли к выводу, что паравентрикулярное ядро таламуса играет ключевую роль в формировании зависимости (по крайней мере, опиоидной), причем роль эта — двойная. За счет своей связи с несколькими участками, участвующими в формировании зависимости, это ядро не только руководит изначальным формированием ассоциации между внешними факторами и веществами, но и помогает ей сохраниться в памяти, повышая риск того, что зависимый снова столкнется с чем-то, что заставит его употреблять. Разумеется, это означает, что на связи между паравентрикулярным ядром и остальными участками можно воздействовать с целью избавления от аддикции: по сути, их ингибирование (активирование — в случае с путем между прилежащим ядром и гипоталамусом) «стирает» воспоминания о связи между внешними факторами и зависимостью, помогая предотвратить рецидив.
Нарушить аддиктивную связь могут и внешние факторы: например, в ноябре прошлого года ученым удалось снизить у мышей зависимость от кокаина с помощью нового товарища. В этом случае, однако, активность уже участвующих в зависимости участков мозга не менялась — но к ней добавлялась активность зубчатой извилины, которая участвует в формировании воспоминаний о социальных связях.
Автор: Елизавета Ивтушок