Нейродегенеративные заболевания, такие, как болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (или БАС, или болезнь Лу Герига), связаны с накоплением в нервных клетках токсичных белковых отложений.
Обычно эти нейродегенеративные белки нужны для чего-то полезного, но иногда, как говорится, что-то начинает идти не так. Например, белок бокового амиотрофического склероза, называемый FUS, участвует в разных клеточных процессах, управляя активностью генов. Чтобы управлять активностью генов, нужно сидеть в клеточном ядре. FUS, как и любой другой белок, синтезируется в цитоплазме, но у него в молекуле есть последовательность аминокислот, обеспечивающая ему ядерную прописку: благодаря этой метке FUS может пройти в ядро.
Но в гене FUS может случиться мутация, из-за которой транспортные белки выводят его из ядра в цитоплазму. Молекулы FUS с нарушенной ядерной меткой склонны слипаться друг с другом, образуя те самые токсичные нейродегенеративные белковые отложения. Они формируются в нейронах, связанных с мышцами; постепенно развивается паралич конечностей, потом дело доходи и до других мышц, включая дыхательные.
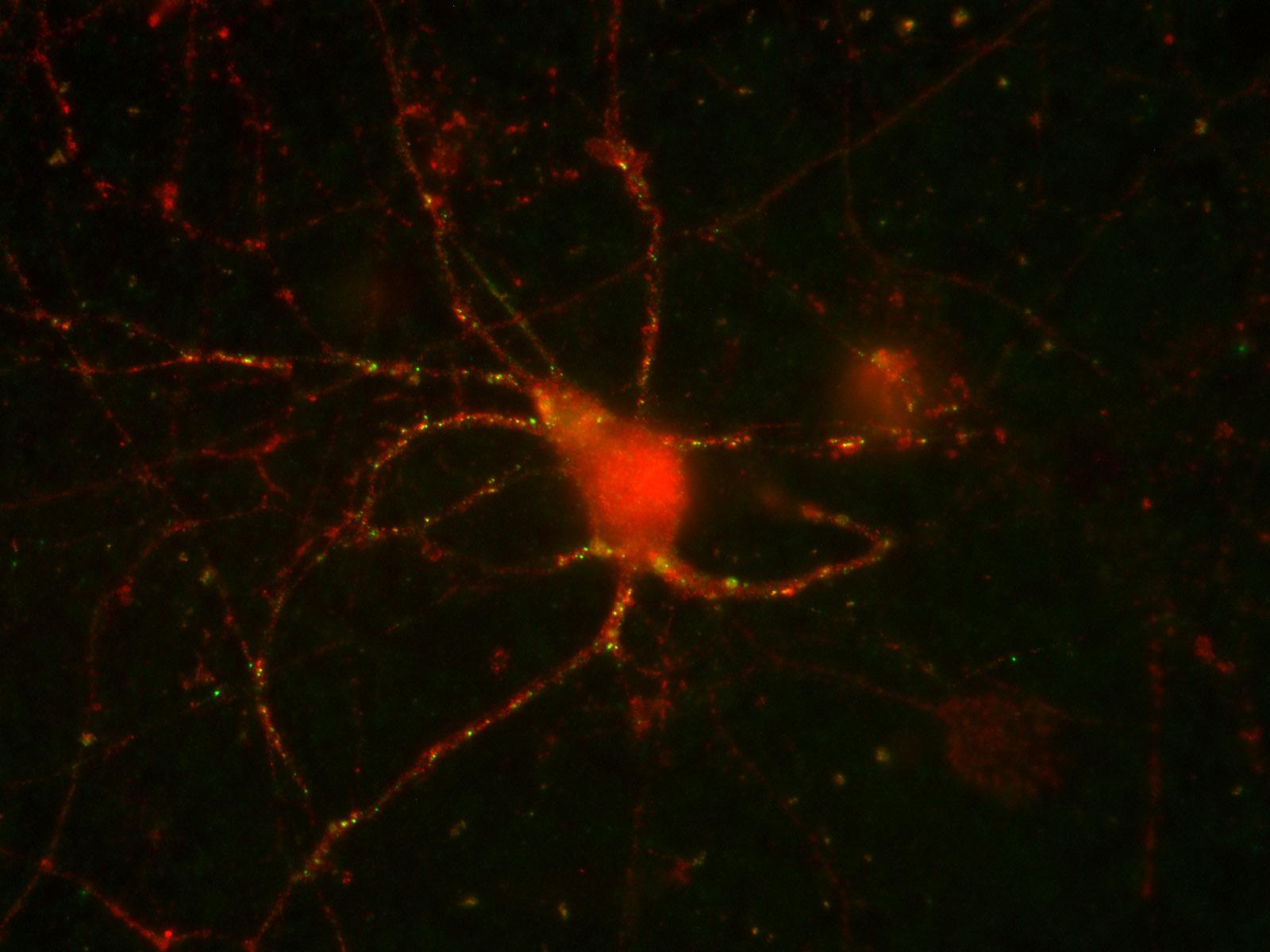
Сотрудники Института физиологически активных веществ РАН совместно с коллегами из Института биологии гена РАН изучали БАС в виде мышиной модели: в геном мышей вставляли ген человеческого FUS, у которого в структуре не было ядерной «прописки» – то есть белок оставался в цитоплазме, где и начинал слипаться. Но у некоторых мышей этот мутантный белок синтезировался очень активно, а у других – не очень активно. У мышей с активно синтезирующимся FUS уже в возрасте четырёх месяцев в нейронах появлялись крупные белковые включения, быстро прогрессировали двигательные нарушения, развивался паралич конечностей, и вскоре они умирали. Такая картина хорошо отражает основные симптомы БАС у пациентов. А вот у животных с низким уровнем синтеза в цитоплазме нейронов белковых агрегатов не появлялось. У таких мышей не было никаких двигательных нарушений, и жили они столько же, сколько и обычные мыши без мутантного человеческого FUS.
Но ведь медленный прирост патогенного белка – это всё равно прирост, и он всё равно должен был дать о себе знать. Видимо, в нейронах в ответ на появление аномального FUS включаются некие компенсаторные механизмы, которые помогают свести на нет вред от небольших количеств FUS. В статье в Neurochemical Research говорится, что при медленном приросте аномального FUS в нейронах мышей активировались гены, участвующие в создании межклеточных контактов и формировании внеклеточного матрикса, а также гены, помогающие формироваться двигательным нейронам по мере развития нервной системы, и гены, связанные с суточными ритмами. Очевидно, компенсаторные механизмы здесь включаются на разных уровнях, и расшифровать их будет довольно непросто; но с другой стоны, если мы научимся вовремя включать их, это позволит смягчать симптомы бокового амиотрофического склероза и продлевать жизнь больным.
Автор: Кирилл Стасевич