Американские ученые разработали и протестировали на поросятах методику неинвазивного анализа эпигенетической регуляции (путем метилирования) ДНК различных отделов головного мозга. В ней используется специальная диета и спектроскопическая магнитно-резонансная томография (сМРТ). Препринт работы доступен на ресурсе bioRxiv.
Эпигенетическая (то есть не затрагивающая последовательность ДНК) регуляция экспрессии генов играет крайне важную роль в формировании и функционировании органов, а следовательно, и в развитии различных заболеваний. Применительно к мозгу убедительно показана ее связь с широким спектром неврологических, психических и поведенческих расстройств. Одним из основных типов эпигенетической регуляции служит метилирование ДНК, причем наибольшее значение имеет метилирование цитозина в CpG-островках промоторов генов (чем выше его степень, тем ниже экспрессия).
Существующие методы оценки метилирования ДНК требуют взятия фрагментов ткани, что делает их неприменимыми для прямых исследований мозга у человека (за исключением полученных при операциях и посмертных образцов) и динамического мониторинга у модельных животных. Учитывая высокий практический интерес к подобной диагностике, сотрудники Иллинойсского университета в Урбане—Шампейне под руководством Кинга Ли (King Li) решили сделать ее неинвазивной.
Идея их метода основана на том, что тяжелый нерадиоактивный изотоп углерода 13C, которого в природе мало, отличается по магнитно-резонансному спектру от «обычного» 12C. Поскольку донором метильных групп для цитозина выступает аминокислота метионин, замена ее в пище на содержащую в нужном положении углерод-13 (13C-метионин) должна обеспечить эпигенетическое маркирование ДНК именно такими метильными группами (с образованием 13C-5-метилцитозина). Оценить уровень искомого изотопа в различных отделах мозга можно с помощью соответствующей модификации сМРТ.
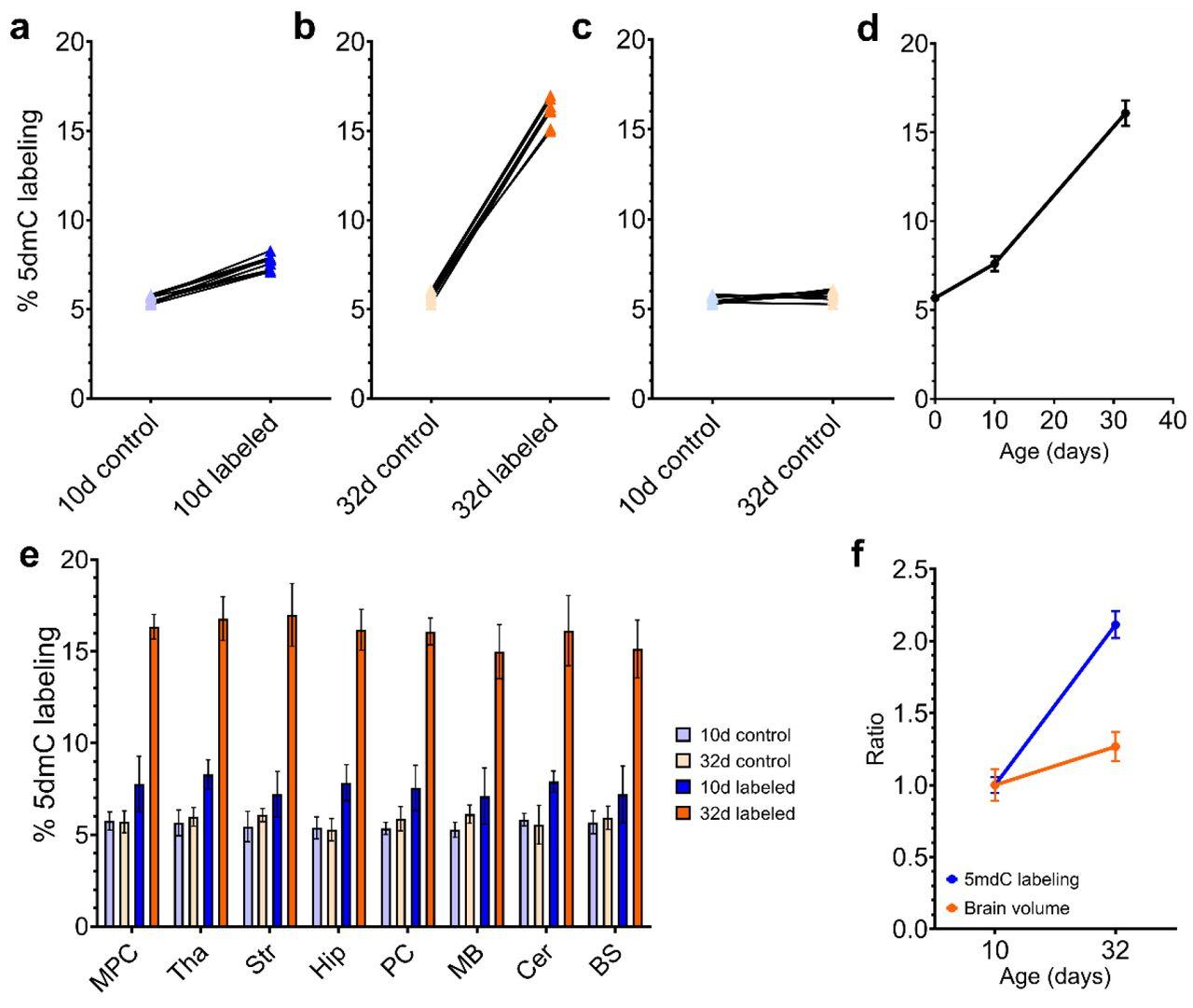
В ходе разработки исследователи приобрели двухдневных поросят и начали откармливать их молочной смесью, сухая масса которой состояла на 30,4 процента из лактозы, на 30,3 — из жира и на 25,4 — из очищенных аминокислот. При этом смесь основной группы содержала 0,5 процента 13C-метионина, а контрольной — столько же обычного его варианта. Часть животных из обеих групп умертвили на 10-й, остальных — на 32-й день.
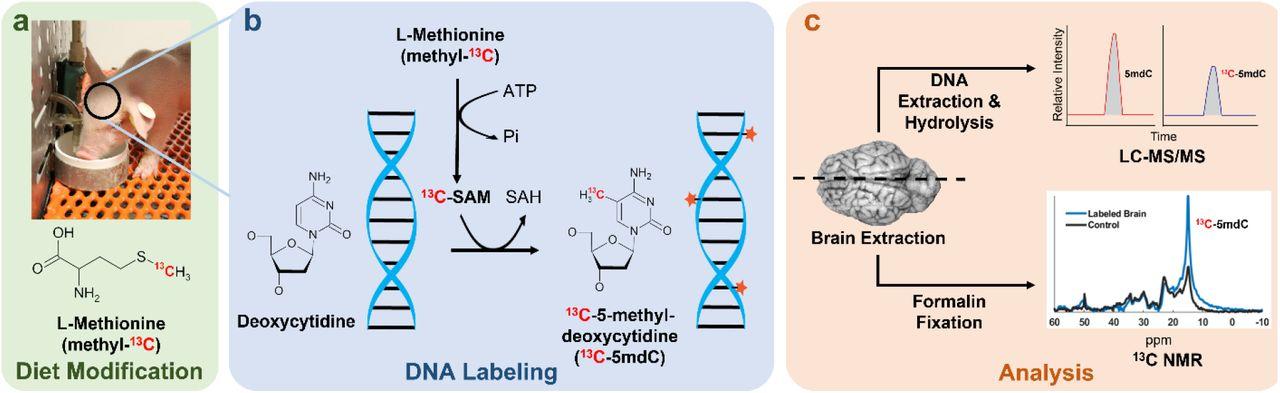
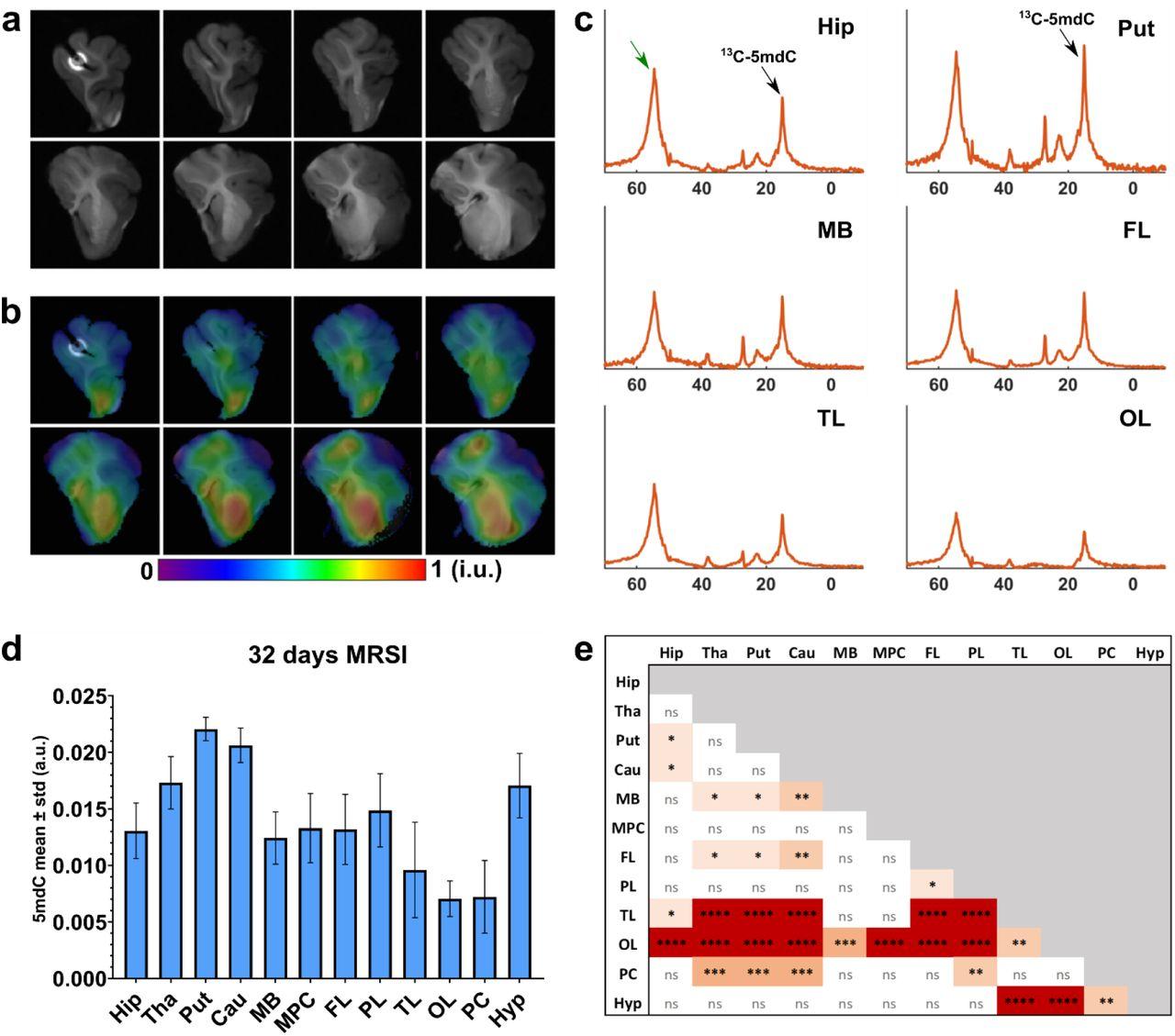
По одному полушарию мозга каждого поросенка препарировали, выделили ДНК из разных отделов и проанализировали с помощью масс-спектрометрии. После 10 дней описанной диеты в восьми отобранных участках мозга животных из контрольной группы наблюдалось повышение уровня 13C-5-метилцитозина на 3–4 процента, спустя 32 дня — более чем на 12 процентов. Это подтвердило эффективность пищевого 13C-метионина для изотопного маркирования метилированной ДНК мозговой ткани.
Что интересно, относительные темпы роста уровня 13C-5-метилцитозина с 10-го по 32-й день значительно превысили динамику увеличения массы как мозга, так и организма в целом за указанный период. По мнению исследователей, это отражает изменения степени эпигенетической регуляции и, как следствие, общей экспрессии генов в процессе нормального развития центральной нервной системы.
В оставшихся цельных полушариях мозга, погруженных в перфторуглеродное масло (для максимального приближения к условиям in vivo), динамику 13C-метилирования по сравнению с контрольной группой определили с помощью 13C-ядерной сМРТ. Низкую чувствительность этого метода удалось компенсировать использованием питательной смеси с высокоочищенным 13C-метионином, сверхвысокопольных томографов и усовершенствованных алгоритмов обработки сигнала. Анализ показал высокое соответствие результатов сМРТ и масс-спектрометрии.
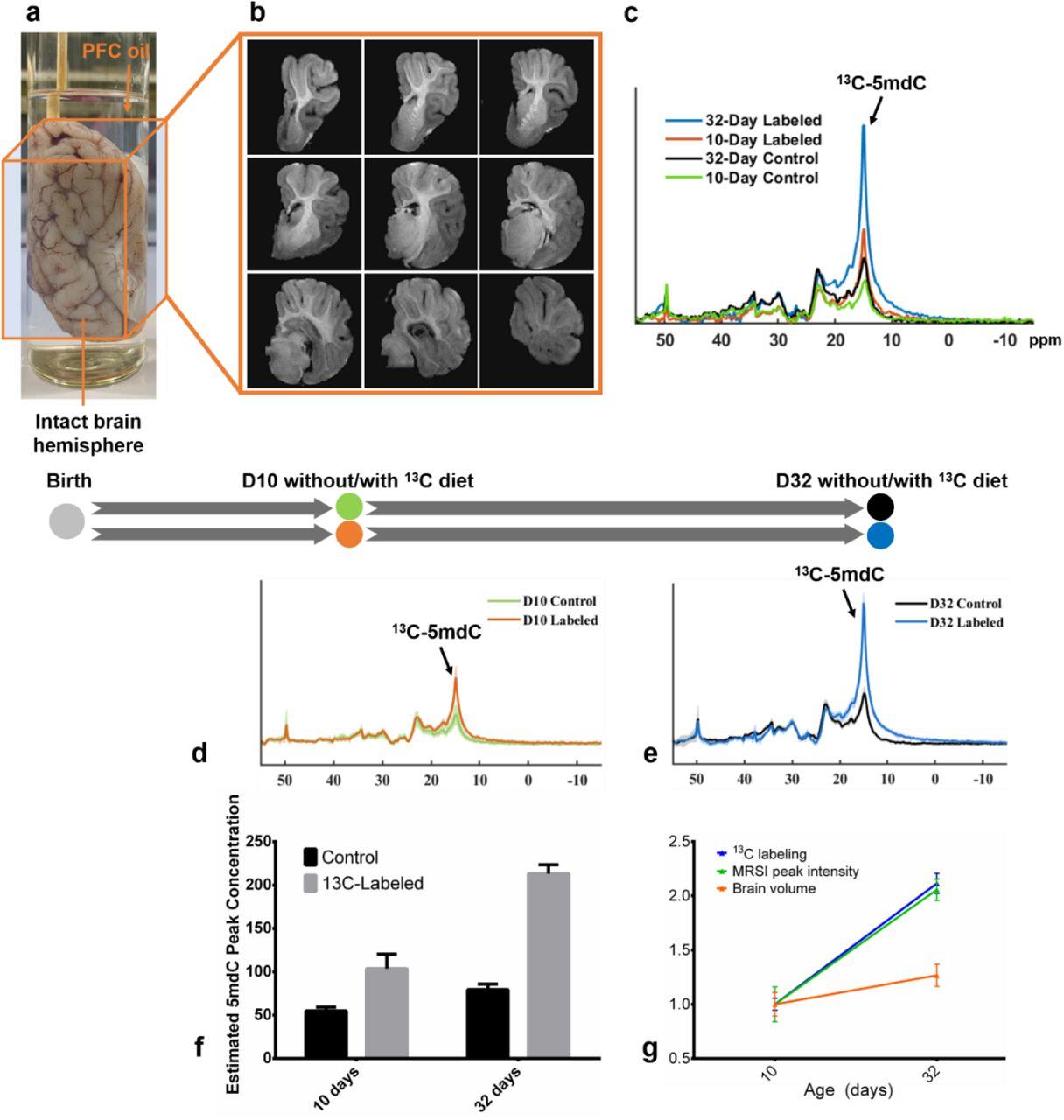
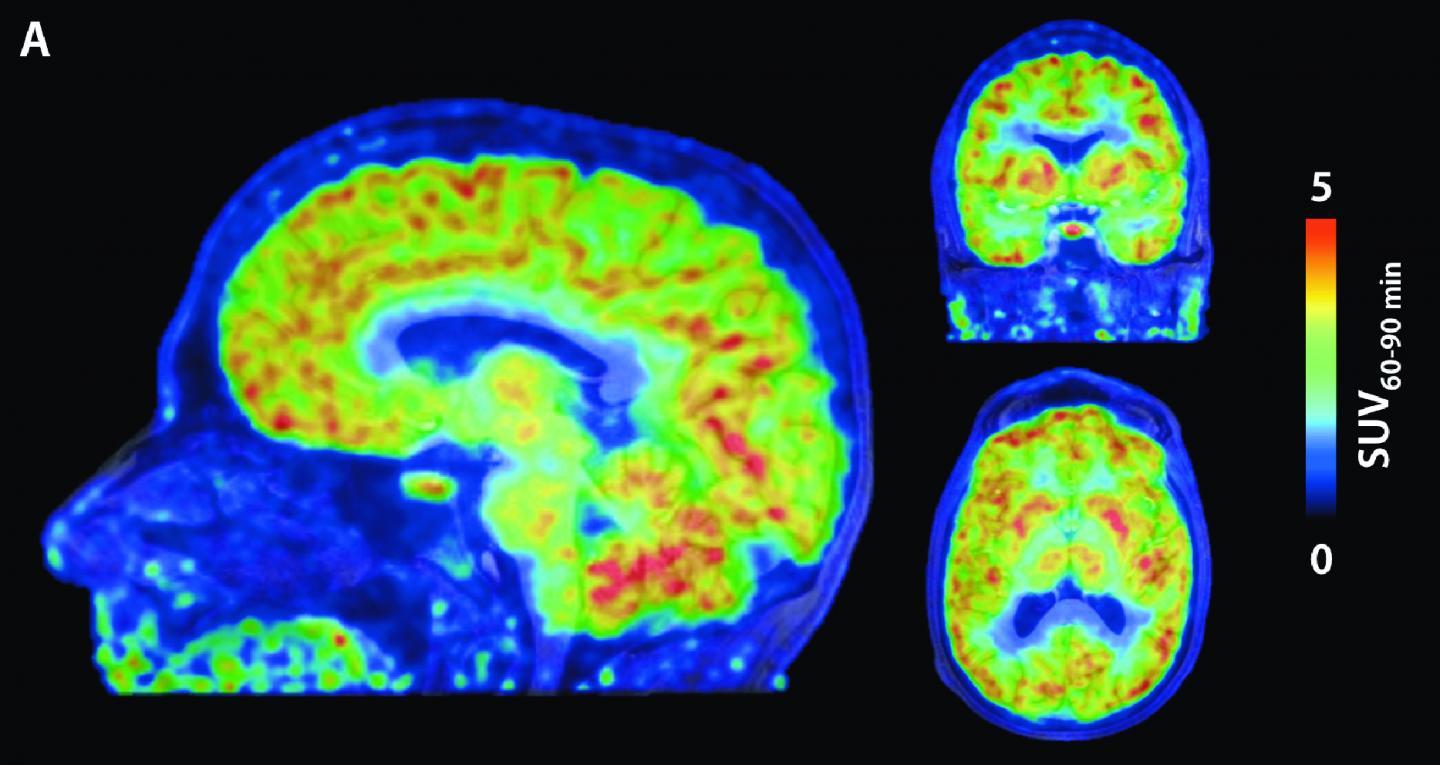
В заключение исследователи успешно применили сМРТ для картирования пространственного распределения метилированной ДНК в цельных полушариях мозга. Наиболее сильные сигналы были получены от скорлупы, хвостатого ядра и таламуса, более слабые — от височной и затылочной долей.
Как отмечают авторы работы, разработанная методика, названная эпигенетической МРТ (эМРТ), не позволяет оценить метилирование отдельных генов, однако и ее разрешающая способность дает существенный объем информации. В качестве аналогии можно привести функциональную МРТ, которая дает картину активации различных участков мозга в реальном времени по измерению интенсивности кровотока, при этом не регистрируя возбуждение отдельных нейронов.
Исследование, пока не прошедшее рецензирование, имеет несколько очевидных ограничений. К примеру, в нем использовали новорожденных поросят, у которых метионин усваивается организмом и метаболизируется в мозге значительно интенсивнее, чем у взрослых животных. Кроме того, до стадии реальных испытаний in vivo авторы пока не дошли. Также при внедрении эМРТ в клиническую практику она сможет определить лишь динамику метилирования ДНК во время употребления меченной аминокислоты, но не его исходный уровень. Несмотря на это, разработка открывает широкие перспективы для нейробиологических исследований.
Ранее сотрудникам Массачусетской больницы общей практики удалось проследить в реальном времени другой (по современным данным, менее значимый) процесс эпигенетической регуляции работы мозга — ацетилирование связанных с ДНК белков-гистонов. Для этого они использовали позитронно-эмиссионную томографию с радиофармакологическим препаратом мартиностатом, помеченным радиоактивным углеродом-11.
Автор: Олег Лищук