Попытки восстановить потерянное зрение при погибших фоторецепторах сетчатки ведутся постоянно. Один из многообещающих подходов – оптогенетическая терапия.
В этом случае светочувствительные белки, похожие на те, что есть у фоторецепторов, встраиваются в другие клетки сетчатки – например, ганглионарные нейроны. Исследователи на страницах журнала Nature Communications рассказали о новом подходе, который позволит проверить эффективность подобной терапии in vivo.
Сетчатка глаза – структура слоистая, и в ее состав входит как минимум шесть различных типов клеток – как нервные, так и глиальные. Для того, чтобы мы получали полноценную информацию о внешнем мире, необходимо, чтобы фоторецепторы – клетки, которые генерируют нервный импульс в ответ на поступающий свет – работали адекватно и не «ломались». Однако, вследствие некоторых заболеваний (например, макулярной дистрофии, пигментного ретинита) фоторецепторы могут разрушаться, и человек слепнет.
Выходом из этой ситуации может послужить «обучение» других клеток сетчатки «видеть» свет, и это становится возможным благодаря оптогенетическому методу. При помощи вирусного вектора (специального вируса) генетическая информация о светочувствительном белке доставляется в нужные, целевые клетки, встраивается в их ДНК, и они начинают производить этот белок, который встраивается в их мембрану. После чего клетки, которые до сих пор не могли «отвечать» на свет, начинают на него реагировать.
Подобная технология разрабатывается уже не один год. Однако очень сложно полученные результаты на животных моделях переносить на человека, поскольку, как правило, в качестве моделей используются грызуны, а их оптическая система глаза сильно отличается от человеческой. Идеальны в этом отношении приматы, но здесь тоже встает проблема, уже этического характера. До сих пор эффективность проведенного оптогенетического лечения можно было оценивать при помощи регистрации электрического ответа клеток лишь в удаленной ткани, что несовместимо с жизнью животного. Понятно, что подобный подход не применим в случае клинических испытаний технологии на человеке.
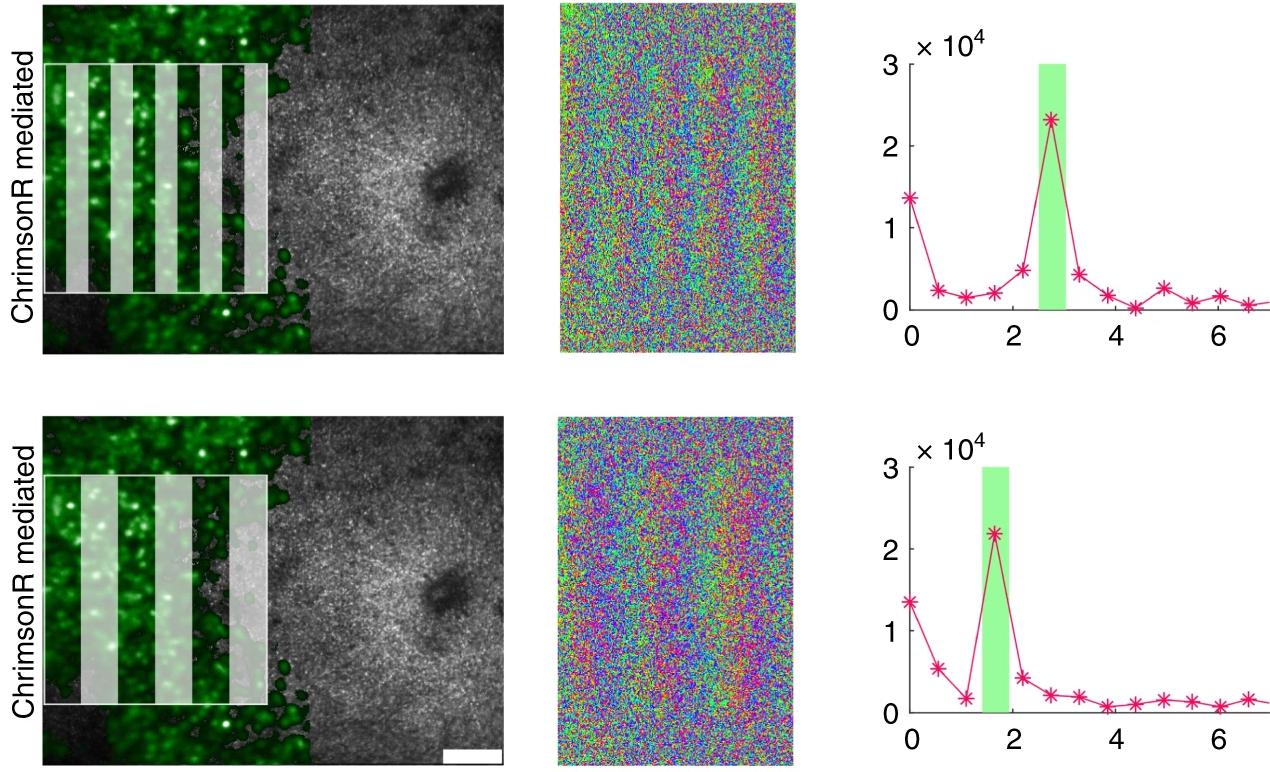
Группа исследователей из Рочестерского университета придумала, как можно анализировать работу оптогенетически измененных клеток сетчатки in vivo – в живом организме. Они объединили адаптивную оптическую сканирующую световую офтальмоскопию (AOSLO) и кальциевую визуализацию (она дает понять, когда клетка активируется).
Ученые провели серию опытов и внедрили в ганглионарные нейроны сетчатки обезьян – макак Macaca fascicularis – светочувствительный белок опсин, причем, таким образом, чтобы модифицированные нейроны образовали кольцо. Далее в течение года при помощи своих методик они регистрировали активность фоторецепторов и ганглионарных клеток, сравнивая ее между собой, и не обнаружили практически никакой разницы. Нужно сказать, что для эксперимента специально выбрали именно ту зону сетчатки – центральную ямку (fovea centralis в центре желтого пятна), где концентрируются исключительно колбочки, отвечающие за цветовое зрение. При этом ямка – самая тонкая часть сетчатки.
Убедившись в том, что технология работает, исследователи провели абляцию фоторецепторов (то есть имитировали потерю зрения) и в течение двух недель успешно продолжали регистрировать сигнал от ганглионарных клеток с помощью разработанной платформы оптической стимуляции и визуализации in vivo.
Авторы работы отмечают, что их методику можно использовать для оценки любой стратегии восстановления зрения на доклинической стадии. Это необходимо, чтобы как можно лучше уточнить то, какие виды терапии имеют перспективу выйти в клинические испытания на людях.
Текст: Анна Хоружая